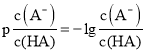题目内容
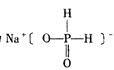
【题目】(1)已知:氢化钠(NaH)为白色晶体,其中H-有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价,写出其化学反应方程式,并用双线桥标出电出电子转移的方向与数目______________________
(2)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用A粉还原NO3-,发生的反应可表示如下,请配平下列反应方程式: ![]() ____、____、____、____、____、___、
____、____、____、____、____、___、
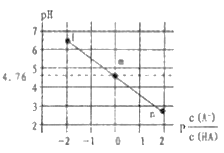
(3)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:![]()
①该反应的氧化剂是____________氧化产物与还原产物的物质的量比是 __________
②如果反应生成0.3mol的单质碘,则转移的电子数目是_____________
③先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,静置后观察到的现象是_________________________
【答案】![]() 10 6 4 2 3 10 KIO3 5:1 3.01x103 溶液分层,上层无色,下层紫红色
10 6 4 2 3 10 KIO3 5:1 3.01x103 溶液分层,上层无色,下层紫红色
【解析】
(1)NaH中Na为+1价,则H为1价,为最低价态,可被氧化,具有还原性,氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价,则应生成HCl,反应的方程式为2NaH+TiCl4═Ti+2HCl+2NaCl,电子转移方向和数目可表示为![]() ,
,
答案为:![]() ;
;
(2)反应中Al→AlO2,Al元素化合价由0价升高为+3价,共升高3价,NO3→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由电荷守恒可知系数为,由H元素守恒可知系数为,故配平后离子方程式为:10Al+6NO3+4OH=10AlO2+3N2↑+2H2O,
答案为:10;6;4;2;3;10;
(3)氧化还原反应KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,KIO3中的I元素的化合价由+5价降低为0,得电子发生还原反应,做氧化剂;KI中的I元素的化合价由1价升高为0,失电子发生氧化反应,做还原剂;化合价升高值=化合价降低值=转移电子数=5,还原产物与氧化产物均为碘,由原子守恒及反应可知,物质的量之比为1:5,
故答案为:KIO3;5:1;
(4)碘易溶于有机溶剂,在四氯化碳在的溶解度远大于在水中,加入四氯化碳萃取水中的碘,四氯化碳与水不互溶,溶液分成两层,四氯化碳的密度比水大,有机层在下层,碘溶于四氯化碳呈紫红色,上层几乎无色,下层呈紫(红)色,
故答案为:溶液分层,上层无色,下层呈紫红色。

 走进文言文系列答案
走进文言文系列答案【题目】实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
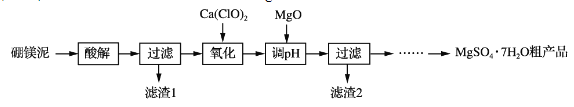
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时为提高Mg2+的浸出率,可采用的措施是_____(写一种)。所加酸不宜过量太多的原因是_____。
(2)“氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为______________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________________________。
(3)“调pH”时用MgO而不用NaOH溶液的原因是________________________。
(4)结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,_________________________________________________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)附:两种盐的溶解度(g/100 g水)
温度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |
【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。
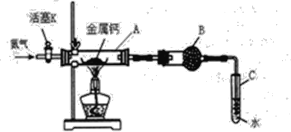
(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。