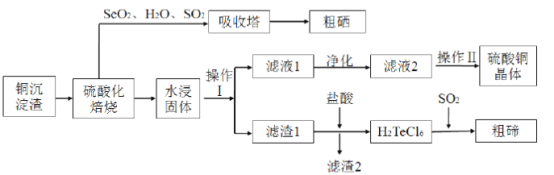
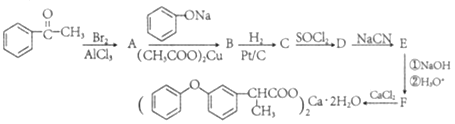
题目内容
【题目】下表是元素周期表中短周期的一部分,表中所列字母分别代表一种元素。
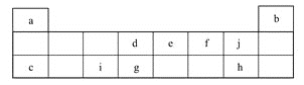
(1)上述元素的单质中熔点最高的可能是________(填字母);dh4比gh4稳定,其原因是______。
(2)f和a所形成的物质的沸点在f相应主族元素的同类型化合物中比较高,其原因是_____________。
(3)f的氢化物属于___晶体,a与d形成的化合物da4的立体构型是___,它的晶体属于_____晶体。
(4) c、i、j可组成离子化合物cxij6,其晶胞结构如下图所示,阳离子c+(用○表示)位于正方体棱的中点和正方体内部;阴离子ij6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是________。

【答案】d 碳的原子半径比硅的原子半径小,C—Cl键的键能比Si—Cl键的键能大 水分子之间存在氢键 分子 正四面体 分子 Na3AlF6
【解析】
由元素周期各元素相对位置可知,a、b、c、d、e、f、g、h、i、j分别是H、He、Na、C、N、O、Si、Cl、Al、F。
(1)元素单质的熔点最高,则该单质属于原子晶体,硅单质、碳的单质都可以形成原子晶体,但是C-C键键长比Si-Si键键长短,C-C键更强,故碳的单质熔点可能最高。dh4和gh4分别为CCl4和SiCl4,碳的原子半径比硅的原子半径小,C—Cl键的键能比Si—Cl键的键能大;
(2) f和a所形成的物质为H2O,水分子之间存在氢键,沸点在第VIA族的同类型化合物中比较高;
(3) f的氢化物是H2O,属于分子晶体。da4是CH4,sp3杂化,立体构型是正四面体,CH4由分子构成,属于分子晶体;
(4) 阳离子Na+个数:12![]() +8+1=12,阴离子AlF6x-个数:8
+8+1=12,阴离子AlF6x-个数:8![]() +6
+6![]() =4,阴阳离子个数比=4:12=1:3,化合物中电荷代数和为0,所以x=3。则其化学式为Na3AlF6。
=4,阴阳离子个数比=4:12=1:3,化合物中电荷代数和为0,所以x=3。则其化学式为Na3AlF6。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案