题目内容
【题目】X、Y、Z、W、Q五种元素,原子序数均小于36,它们的核电荷数依次增加,且核外电子数之和为54。X的激发态原子电子排布式为![]() ,Y原子的基态原子
,Y原子的基态原子![]() 能级上有两个未成对电子,在同周期中Z的基态原子中未成对电子数最多,W的电离能如下表所示,基态Q原子的K层电子数与最外层电子数之比为2∶1,其d轨道处于全充满状态。
能级上有两个未成对电子,在同周期中Z的基态原子中未成对电子数最多,W的电离能如下表所示,基态Q原子的K层电子数与最外层电子数之比为2∶1,其d轨道处于全充满状态。
元素 | 第一电离能 | 第二电离能 | 第三电离能 |
W | 495.8 | 4562 | 6910.3 |
(1)基态Q原子价电子排布式为_____。
(2)X、Y、Z、Q电负性由大到小排序为___(写元素符号)
(3)X与Z形成的化合物![]() ,Z原子采取的杂化轨道类型为___,Z的最高价氧化物的水化物的正盐的阴离子的空间构型为____;
,Z原子采取的杂化轨道类型为___,Z的最高价氧化物的水化物的正盐的阴离子的空间构型为____;
(4)W的氯化物和![]() 的氧化物中,熔点较高的是____(填化学式),原因是_____。
的氧化物中,熔点较高的是____(填化学式),原因是_____。
(5)由X、Y组成的一种微粒结构如图![]() ,请写出该微粒的化学式:_____。
,请写出该微粒的化学式:_____。
(6)图(a)是![]() 的拉维斯结构,
的拉维斯结构,![]() 以金刚石方式堆积,半数的四面体空隙中,填入以四面体方式排列的Q。图(b)是沿立方格子对角面取得的截图。设阿伏加德罗常数的值为
以金刚石方式堆积,半数的四面体空隙中,填入以四面体方式排列的Q。图(b)是沿立方格子对角面取得的截图。设阿伏加德罗常数的值为![]() ,则
,则![]() 的密度是_____
的密度是_____![]() (列出计算表达式)。
(列出计算表达式)。


【答案】![]()
![]()
![]() 平面三角形
平面三角形 ![]()
![]() 和
和![]() 都为离子晶体,
都为离子晶体,![]() 和
和![]() 半径小,电荷数大,因此
半径小,电荷数大,因此![]() 晶体的晶格能大,熔点高
晶体的晶格能大,熔点高 ![]()
![]()
【解析】
Y原子的基态原子2p上有两个未成对电子,则Y可能是C,也可能是O,根据W的电离能,推出W最外层只有1个电子,属于IA族,因为原子序数依次增大,因此Z位于第二周期,Z是同周期中未成对电子数最多,即Z为N,Y为C,基态Q原子的d轨道处于全充满状态,K层电子数为2,最外层电子数为1,即该元素为Cu,五种元素核外电子数之和为54,则X为H,据此分析;
(1)根据上述分析,Q为Cu,位于第四周期IB族,价电子包括最外层电子和次外层的d能级上的电子,即价电子排布式为3d104s1;
答案为3d104s1;
(2)一般非金属性越强,电负性越大,因此顺序是N>C>H>Cu;
答案为N>C>H>Cu;
(3)该化合物为N2H4,N2H4的电子式为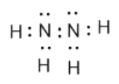 ,因此N的杂化类型为sp3,Z的最高价氧化物的水化物的正盐的阴离子是NO3-,其中N有3个σ键,孤电子对数为
,因此N的杂化类型为sp3,Z的最高价氧化物的水化物的正盐的阴离子是NO3-,其中N有3个σ键,孤电子对数为![]() =0,价层电子对数为3,即NO3-空间构型为平面三角形;
=0,价层电子对数为3,即NO3-空间构型为平面三角形;
答案为sp3;平面三角形;
(4)W的氯化物是NaCl,Mg的氧化物是MgO,两者都属于离子化合物,离子晶体的熔点与晶格能有关,离子半径越大、所带电荷数越大,晶格能越高,熔点越高,Mg2+、O2-的半径分别小于Na+、Cl-,且Mg2+、O2-所带电荷数大于Na+、Cl-,MgO晶格能大于NaCl,即MgO的熔点高于NaCl;
答案为MgO;NaCl、MgO都为离子晶体,Mg2+和O2-半径小,电荷数大,因此MgO晶体的晶格能大,熔点高;
(5)C、H组成一种微粒,结合该微粒的球棍模型,C的半径大于H,即该微粒的化学式为CH3-;
答案为CH3-;
(6)MgQ2的化学式为MgCu2,根据晶胞的结构,Mg位于8个顶点、6个面心上,在晶胞内部有4个Mg原子,Mg原子个数为![]() =8,则Cu的个数为16个,晶胞的质量为
=8,则Cu的个数为16个,晶胞的质量为![]() g,晶胞的体积为(a×10-10)3cm3,根据密度的定义得出晶胞的密度是
g,晶胞的体积为(a×10-10)3cm3,根据密度的定义得出晶胞的密度是![]() g/cm3;
g/cm3;
答案为![]() 。
。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案









