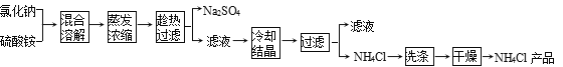
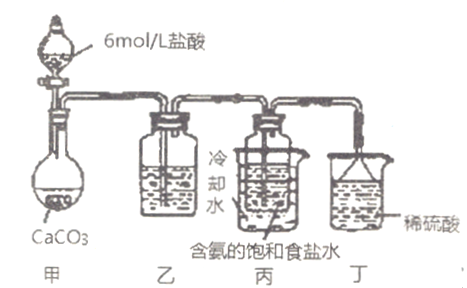
题目内容
【题目】工业上用CO和H2反应制备二甲醚(CH3OCH3)的条件是压力2.0~10.0MPa,温度300℃。设备中进行下列反应,请回答下列问题:
①CO(g)+2H2(B)![]() CH3OH(g) △H=-90.7kJ/mol
CH3OH(g) △H=-90.7kJ/mol
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
(1)总反应3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g)的△H=_____________ 。据此可判断该反应_________________条件下自发。
(2)在温度和容积不变的条件下发生反应①,能说明该反应达到平衡状态的依据是_____
a.容器中压强保持不变 b.混合气体中c(CO)不变
c.v正(CO)= v逆(H2) d.c(CH3OH)= c(CO)
(3)在2L 的容器中加入amol CH3OH(g)发生反应②,达到平衡后若再加入amolCH3OH(g)重新达到平衡时,CH3OH 的转化率____________(填“增大”、“ 减小”或“不变”)。
(4)850℃时在一体积为10L 的容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示。
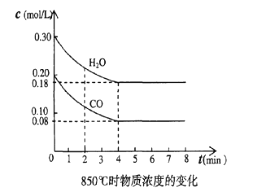
①0~4min 的平均反应速率,v(CO)=________________ 。
②若温度不变,向该容器中加入4mo1CO(g)、2mo1H2O(g)、3mo1CO2(g)和3molH2(g),起始时v正(CO)______v逆(H2)(填“<”、“ >”或“=”),请结合必要的计算说明理由。________。
【答案】 -246.1kJ/mol 低温 ab 不变 0.03mol/(L·min) < Qc = (0.3mol/L×0.3mol/L)/(0.4 mol/L×0.2 mol/L)=9/8,K = (0.12 mol/L×0.12 mol/L)/(0.08mol/L×0.18 mol/L)=1.0,因为Qc>K,平衡左移,所以v正<v逆。
【解析】(1)本题考查热化学反应方程式的计算,以及化学反应进行的方向,①×2+②+③得出:△H=[2×(-90.7)-23.5-41.2]kJ·mol-1=-246.1kJ·mol-1,根据△G=△H-T△S,△H<0,此反应△S<0,因此△G<0,条件是高温;(2)本题考查化学平衡状态的判断,a. 、根据化学反应方程式,反应前后气体系数之和不相等,因此当压强不再改变,说明反应达到平衡,故a正确;b、根据化学平衡状态的定义,因此混合气体c(CO)不变,说明反应达到平衡,故b正确;c、用不同物质的化学反应速率表示达到平衡,要求反应方向是一正一逆,且化学反应速率之比等于化学计量数之比,因此有2v正(CO)=v逆(H2),故c错误;d、因为没有说明开始时的投入量,因此c(CH3OH)= c(CO),不能说明反应达到平衡,故d错误;(3)本题考查化学平衡的移动,再加入amolCH3OH,相当于在原来的基础上增大压强,反应前后气体系数之和相等,因此增大压强平衡不移动,即CH3OH的转化率不变;(4)考查化学反应速率的计算以及Qc和K的关系,①根据化学反应速率的数学表达式,v(CO)=(0.20-0.08)/4mol/(L·min)=0.03 mol/(L·min);②Qc = (0.3mol/L×0.3mol/L)/(0.4 mol/L×0.2 mol/L)=9/8,K = (0.12 mol/L×0.12 mol/L)/(0.08mol/L×0.18 mol/L)=1.0,因为Qc>K,平衡左移,所以v正<v逆。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案