题目内容
【题目】我国化工专家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
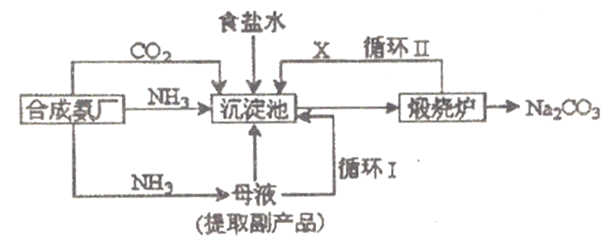
(1)上述流程中X物质的电子式为__________________。
(2)沉淀池中发生的化学反应方程式是_______________________,煅烧炉中发生的化学反应方程式是___________________________。
(3)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______________________
(4)请你再写出一种实验室制取少量碳酸氢钠的方法:(用化学反应方程式来描述)_____________________________。
(5)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学按如下方案进行
实验:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
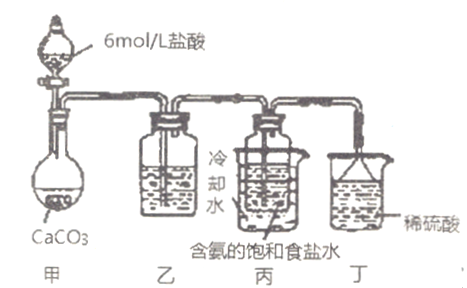
请回答:
①甲中发生反应的离子方程式是_____________________。
丁中发生反应的离子方程式是__________________。
②乙装置中的试剂是___________________。
【答案】 ![]() NH3+H2O+CO2+NaCl=+NaHCO3↓或NH3+H2O+CO2=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl 2NaHCO3
NH3+H2O+CO2+NaCl=+NaHCO3↓或NH3+H2O+CO2=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl 2NaHCO3![]() Na2CO3+H2O+CO2 碳酸氢钠的溶解度相对小 NaOH+CO2=NaHCO3;或Na2CO3+CO2+H2O=2NaHCO3 CaCO3+2H+=Ca2++CO2↑+H2O NH3+H+=NH4+ 饱和NaHCO3溶液
Na2CO3+H2O+CO2 碳酸氢钠的溶解度相对小 NaOH+CO2=NaHCO3;或Na2CO3+CO2+H2O=2NaHCO3 CaCO3+2H+=Ca2++CO2↑+H2O NH3+H+=NH4+ 饱和NaHCO3溶液
【解析】本题考查化学工艺流程和实验方案设计与评价,(1)根据流程图,沉淀池制备碳酸氢钠,沉淀池发生NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,煅烧炉发生2NaHCO3 ![]() Na2CO3+CO2↑+H2O,气体X为CO2,其电子式为
Na2CO3+CO2↑+H2O,气体X为CO2,其电子式为![]() ;(2)根据(1)的分析,沉淀池中发生的是NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,碳酸氢钠不稳定,受热易分解,煅烧炉中发生的是2NaHCO3
;(2)根据(1)的分析,沉淀池中发生的是NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,碳酸氢钠不稳定,受热易分解,煅烧炉中发生的是2NaHCO3 ![]() Na2CO3+CO2↑+H2O;(3)因为碳酸氢钠的溶解度相对较小,因此NH4HCO3+NaCl=NaHCO3↓+NH4Cl;(4)NaOH+CO2=NaHCO3;或Na2CO3+CO2+H2O=2NaHCO3;(5)①甲中发生的反应是CaCO3+2H+=Ca2++CO2↑+H2O;丙中盛放的是含氨的饱和食盐水,会有少量NH3挥发,因此装置丁的作用是除去挥发的NH3,即离子方程式NH3+H+=NH4+;②盐酸具有挥发性,产生的CO2中混有HCl,干扰NaHCO3的制备,必须除去HCl,除去CO2中混有HCl,常用饱和的碳酸氢钠溶液,即乙装置盛放饱和NaHCO3溶液。
Na2CO3+CO2↑+H2O;(3)因为碳酸氢钠的溶解度相对较小,因此NH4HCO3+NaCl=NaHCO3↓+NH4Cl;(4)NaOH+CO2=NaHCO3;或Na2CO3+CO2+H2O=2NaHCO3;(5)①甲中发生的反应是CaCO3+2H+=Ca2++CO2↑+H2O;丙中盛放的是含氨的饱和食盐水,会有少量NH3挥发,因此装置丁的作用是除去挥发的NH3,即离子方程式NH3+H+=NH4+;②盐酸具有挥发性,产生的CO2中混有HCl,干扰NaHCO3的制备,必须除去HCl,除去CO2中混有HCl,常用饱和的碳酸氢钠溶液,即乙装置盛放饱和NaHCO3溶液。

【题目】(1)实验室配制1000mL0.50mol·L-1的Na2CO3溶液,在常用仪器中应选用______mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度______0.50mol·L-1(填“大于”、“小于”或“等于”)。
(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在______式滴定管中。若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
则c(HCl)=______mol·L-1。
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度______,若原来配制所称取的Na2CO3固体中混有Na2CO3·10H2O,则实验误差为______(以上两空填“偏高”、“偏低”或“无影响”)
(4)常温下向20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:

①请写出AB段反应的离子方程式___________________________________
当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)_____________________________________________________________________________