ЬтФПФкШн
ЁОЬтФПЁПФГЭЌбЇЩшМЦЪЕбщжЄУїЭгыХЈСђЫсФмЗЂЩњЗДгІЃЌВЂМьбщЩњГЩЦјЬхЕФаджЪЃЌШчЭМЫљЪОЃЌдкЪдЙмРяМгШы2mLХЈСђЫсЃЌгУДјЕМЙмКЭвЛИіаЁПзЕФНКЙмШћНєЃЌДгПзжаВхШывЛИљЭЫПЃЌМгШШЃЌАбЗХГіЕФЦјЬхвРДЮЭЈШыЦЗКьШмвККЭЪЏШяШмвКжаЁЃЧыЛиД№ЯТСаЮЪЬтЃК
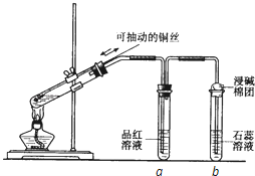
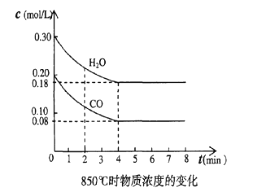
ЃЈ1ЃЉаДГіЭгыХЈСђЫсЗДгІЕФЛЏбЇЗНГЬЪНЃК________ЁЃ
ЃЈ2ЃЉЪдЙмaЁЂbЗжБ№МьбщЩњГЩЦјЬхЕФаджЪЃЌаДГіЙлВьЕНЕФЯжЯѓМАЦфзїгУЁЃ
ЪдЙмaжаЕФЯжЯѓЪЧ________ЃЌ зїгУЪЧ________ЃЛЪдЙмbжаЕФЯжЯѓЪЧ________ЃЌзїгУЪЧ________ЁЃ
ЁОД№АИЁПCu+2H2SO4ЃЈХЈЃЉ![]() CuSO4+2H2O+SO2Ёќ ЦЗКьШмвКЭЪЩЋжЄУїЖўбѕЛЏСђОпгаЦЏАзадзЯЩЋЪЏШяЪдвКБфКьжЄУїЖўбѕЛЏСђШмгкЫЎЯдЪОЫсад
CuSO4+2H2O+SO2Ёќ ЦЗКьШмвКЭЪЩЋжЄУїЖўбѕЛЏСђОпгаЦЏАзадзЯЩЋЪЏШяЪдвКБфКьжЄУїЖўбѕЛЏСђШмгкЫЎЯдЪОЫсад
ЁОНтЮіЁП
ЃЈ1ЃЉЭгыХЈСђЫсЗДгІЩњГЩСђЫсЭЁЂЖўбѕЛЏСђЦјЬхКЭЫЎЃЌОнДЫаДГіЗДгІЕФЛЏбЇЗНГЬЪНЃЛЃЈ2ЃЉЖўбѕЛЏСђОпгаЦЏАзадЃЌФмЙЛЪЙЦЗКьШмвКЭЪЩЋЃЛЖўбѕЛЏСђЮЊЫсадбѕЛЏЮяЃЌШмгкЫЎЯдЪОЫсадЁЃ
ЃЈ1ЃЉЭИњХЈСђЫсЗДгІЃЌЭОпгаЛЙдадЃЌХЈСђЫсОпгаЧПбѕЛЏадЃЌЗДгІБиаыМгШШВХФмЗЂЩњЃЌЪщаДЛЏбЇЗНГЬЪНЪБзЂвтЁАХЈЁБзжЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃКCu+2H2SO4ЃЈХЈЃЉCuSO4+2H2O+SO2ЁќЃЛЃЈ2ЃЉЖўбѕЛЏСђОпгаЦЏАзадЃЌФмЙЛЪЙЦЗКьШмвКЭЪЩЋЃЌЫљвдЪдЙмaжаЦЗКьШмвКЭЪЩЋЃЌФПЕФЪЧжЄУїЖўбѕЛЏСђОпгаЦЏАзадЃЛЖўбѕЛЏСђЪєгкЫсадбѕЛЏЮяЃЌШмгкЫЎКѓШмвКЯдЪОЫсадЃЌФмЙЛЪЙзЯЩЋЕФЪЏШяЪдвКБфКьЃЌЙЪД№АИЮЊЃКЦЗКьШмвКЭЪЩЋЃЛжЄУїЖўбѕЛЏСђОпгаЦЏАзадЃЛзЯЩЋЪЏШяЪдвКБфКьЃЛжЄУїЖўбѕЛЏСђШмгкЫЎЯдЪОЫсадЁЃ

 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИЁОЬтФПЁПЃЈ1ЃЉЪЕбщЪвХфжЦ1000mL0.50molЁЄL-1ЕФNa2CO3ШмвКЃЌдкГЃгУвЧЦїжагІбЁгУ______mLЕФШнСПЦПЃЌГЦСПЪБШєНЋЗЈТыЗХдкзѓХЬЃЈ1gвдЯТгУгЮТыЃЉЃЌдђХфжЦЕФШмвКЕФЮяжЪЕФСПХЈЖШ______0.50molЁЄL-1ЃЈЬюЁАДѓгкЁБЁЂЁАаЁгкЁБЛђЁАЕШгкЁБЃЉЁЃ
ЃЈ2ЃЉХфжЦЭъБЯКѓЃЌгУБъзМNa2CO3ШмвКЕЮЖЈЮДжЊХЈЖШЕФбЮЫсЪБЃЌNa2CO3ШмвКгІзАдк______ЪНЕЮЖЈЙмжаЁЃШєВЩгУЩЯЪіБъзМNa2CO3ШмвКЕЮЖЈЃЌЕЮЖЈЪБЪЕбщЪ§ОнСаБэШчЯТЃК
ДЮЪ§БрКХ | Д§ВтбЮЫсЬхЛ§ЃЈmLЃЉ | ЕЮШыNa2CO3ШмвКЬхЛ§ЃЈmLЃЉ |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
дђc(HCl)=______molЁЄL-1ЁЃ
ЃЈ3ЃЉШєЪЂзАNa2CO3ШмвКЕФЕЮЖЈЙмдкЕЮЖЈЧАЮДгУБъзМвКШѓЯДЃЌдђзюКѓЫљВтбЮЫсХЈЖШ______ЃЌШєдРДХфжЦЫљГЦШЁЕФNa2CO3ЙЬЬхжаЛьгаNa2CO3ЁЄ10H2OЃЌдђЪЕбщЮѓВюЮЊ______ЃЈвдЩЯСНПеЬюЁАЦЋИпЁБЁЂЁАЦЋЕЭЁБЛђЁАЮогАЯьЁБЃЉ
ЃЈ4ЃЉГЃЮТЯТЯђ20 mL 0.1 molЁЄLЃ1 Na2CO3ШмвКжаж№ЕЮМгШы0.1 molЁЄLЃ1 HClШмвК40 mLЃЌШмвКpHж№НЅНЕЕЭЃЌДЫЪБШмвКжаКЌЬМдЊЫиЕФЮЂСЃЕФЮяжЪЕФСПХЈЖШЕФАйЗжКЌСП(знжс)ЗЂЩњЕФБфЛЏ(CO2вђвнГіЮДЛГі)ШчЭМЫљЪОЃЌИљОнЭМЪОЛиД№ЯТСаЮЪЬтЃК

ЂйЧыаДГіABЖЮЗДгІЕФРызгЗНГЬЪН___________________________________
ЕБЗДгІЕНAЕуЪБЃЌШмвКжаЫљгабєРызгКЭвѕРызгЕФХЈЖШДѓаЁЙиЯЕЮЊ(ТШРызгХЈЖШГ§Эт)_____________________________________________________________________________