题目内容
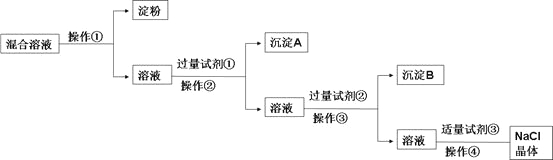
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠的工艺流程如下:
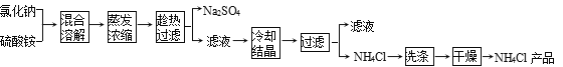
【查阅资料】
①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
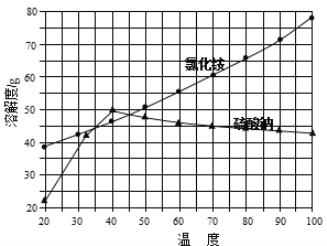
②氯化铵和硫酸钠的溶解度随温度变化曲线如下图所示:
请回答下列问题:
(1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式: 。
(2)欲制备10.7 g NH4Cl,理论上需NaCl质量为 g。
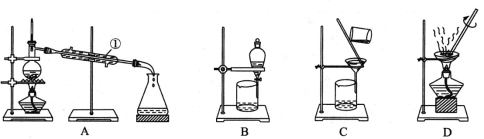
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有 。
(4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
操作步骤 | 现象 | 结论 |
取少量氯化铵产品于试管底部, | 表明氯化铵产品纯净 |
【答案】(1)2NaCl+(NH4)2SO4=2NH4Cl+Na2SO4↓(3分)
(2)11.7(2分)(3)蒸发皿(2分)、玻璃棒(2分)
(4)35℃(3分)加热,试管底部没有残留物(2分)
【解析】
试题分析:(1)氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式为2NaCl + (NH4)2SO4=2NH4Cl + Na2SO4 ↓;
(2)通过分析,依据氯元素守恒可知,1mol氯化钠会生成1mol氯化铵,所以根据NH4Cl---NaCl可知欲制备10.7gNH4Cl即0.2mol氯化铵,理论上需NaCl的质量=0.2mol×58.5g/mol=11.7g;
(3)实验室进行蒸发浓缩用到的主要仪器有蒸发皿、烧杯、玻璃棒、酒精灯等;
(4)根据硫酸钠的溶解度曲线不难看出,在低于40℃时,硫酸钠的溶解度随温度的升高而增大,高于40℃时硫酸钠的溶解度随温度的升高而减小;由两物质的溶解度曲线不难看出,只有在35-45℃时,氯化铵的溶解度小于硫酸钠的溶解度,所以析出NH4Cl晶体的合适温度为35~45℃;
(5)根据氯化铵受热时分解生成了氨气和氯化氢气体,可用加热法检查NH4Cl产品是否纯净,操作是:取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净。

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案