��Ŀ����
����Ŀ����ͼ��ʾ3��ʵ��װ�ã��ֱ�ش��������⣮
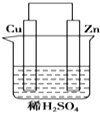
��1��װ��1Ϊ����������ʴʵ�飮�����̼���IJ���Ͳ�ڵ����̪��Һ���ɹ۲쵽̼����������Һ��죬�õ缫��ӦΪ ��
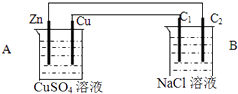
��2��װ��2�е�ʯī�����������������
��3��װ��3�м��ձ�ʢ��100mL 0.2mol/L��NaCl��Һ�����ձ�ʢ��100mL 0.5mol/L��CuSO4��Һ����Ӧһ��ʱ���ֹͣͨ�磮����ձ��е��뼸�η�̪���۲쵽ʯī�缫�������ȱ�죮
�ٵ�Դ��M��Ϊ�������缫�ĵ缫��Ӧ
��ֹͣ��⣬ȡ��Cu�缫��ϴ�ӡ�����������缫����0.64g�����ձ��в����������״�������Ϊ mL��
���𰸡�
��1��O2+4e��+2H2O�T4OH��
��2����
��3������Fe��2e���TFe2+��224
���������⣺��1��װ��1Ϊ����������ʴʵ�飬�����绯ѧ��ʴ����Ϊ������̼Ϊ�������۲쵽̼����������Һ��죬˵����̼���������õ�������OH�����ӣ���Ӧ�ĵ缫��ӦʽΪO2+4e��+2H2O�T4OH�� �� �ʴ�Ϊ��O2+4e��+2H2O�T4OH����
��2.��װ��2Ϊԭ��أ�����ΪCu���缫��ӦΪ��Cu��2e���TCu2+ �� ����Ϊʯī���缫��ӦΪ2Fe+2e���T2Fe2+ �� �ʴ�Ϊ������
��3.���ٷ�Ӧһ��ʱ���ֹͣͨ�磮����ձ��е��뼸�η�̪���۲쵽ʯī�缫�������ȱ�죬˵����ʯī�缫������OH�����ӣ��缫��ӦΪ��2H2O+2e���T2OH��+H2����
������ԭ��Ӧ��Ϊ���ص����������ӵ�Դ�ĸ�������M��Ϊ������N��Ϊ������������ӦΪFe��2e���TFe2+ �� �ʴ�Ϊ������Fe��2e���TFe2+����ȡ��Cu�缫��ϴ�ӡ�����������缫����0.64g��������Cu�����ʵ���Ϊ ![]() =0.01mol��ת�Ƶĵ��ӵ����ʵ���Ϊ0.01mol��2=0.02mol��
=0.01mol��ת�Ƶĵ��ӵ����ʵ���Ϊ0.01mol��2=0.02mol��
���ݼ��ձ���������ĵ缫��Ӧ������������������
2H2O | + | 2e�� | �T | 2OH�� | + | H2�� |
2mol | 22.4L | |||||
0.02mol | V |
V= ![]() =0.224L����224ml���ʴ�Ϊ��224��
=0.224L����224ml���ʴ�Ϊ��224��
��1��װ��1Ϊ����������ʴʵ�飬�����绯ѧ��ʴ����Ϊ������̼Ϊ�������۲쵽̼����������Һ��죬˵����̼���������õ�������OH�����ӣ��Դ��жϲ���д�缫��Ӧʽ����2��װ��2Ϊԭ��أ�����ΪCu������Ϊʯī����3���ٷ�Ӧһ��ʱ���ֹͣͨ�磮����ձ��е��뼸�η�̪���۲쵽ʯī�缫�������ȱ�죬˵����ʯī�缫������OH�����ӣ��缫��ӦΪ��2H2O+2e���T2OH��+H2����������ԭ��Ӧ��Ϊ���ص����������ӵ�Դ�ĸ�������M��Ϊ������N��Ϊ������������ӦΪFe��2e���TFe2+ �� �ڸ��ݵ缫��Ӧ�ʹ�����·������ת�Ƶ��ӵ���Ŀ��Ƚ��м��㣮

����Ŀ����Ԫ�صĻ���������࣬����Ҳ������ͬ��
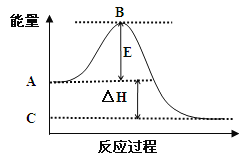
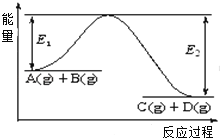
��1��ͼ1Ϊһ���¶���1molNO2��g����1molCO��g����Ӧ����NO��g����CO2��g�������е������仯ʾ��ͼ����֪E1=147.5kJmol��1 �� E2=376.2kJmol��1��E1��E2Ϊ��Ӧ�Ļ�ܣ������ڷ�Ӧ��ϵ�м����������Ӧ����������E1�����������С�����䡱�����÷�Ӧ���Ȼ�ѧ����ʽΪ �� 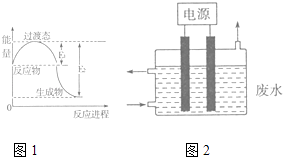
��2������������������OH�����ڵ������·���ˮ�ⷴӦ��
O2NC6H4COOC2H5+OH��O2NC6H4COOO��+C2H5OH
���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050molL��1 �� ij�¶��²��O2NC6H4COOC2H5��ת���ʦ���ʱ��仯���������±���ʾ��
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
��/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
�ش��������⣺�ٸ÷�Ӧ��330s��530s��ƽ����Ӧ����Ϊ��ֻ����ʽ���������㣩
��Ϊ���O2NC6H4COOC2H5��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� �� ��д1�����ɣ�
��3��2015��8��12�����۱�ը����һ�������軯��й¶��������ͼ2��ʾװ�ó�ȥ��CN����Cl����ˮ�е�CN�� �� ������ҺpHΪ9��10������������ClO����CN������Ϊ��������Ⱦ�����壬�÷�Ӧ�����ӷ���ʽΪ �� ���������缫�IJ��Ϸֱ�Ϊʯī��������ʯī��������缫��ӦʽΪ ��