题目内容
【题目】氮元素的化合物种类繁多,性质也各不相同.
(1)图1为一定温度下1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=147.5kJmol﹣1 , E2=376.2kJmol﹣1(E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1(填“增大”、“减小”或“不变”).该反应的热化学方程式为 . 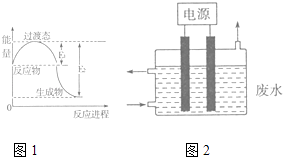
(2)硝基苯甲酸乙酯在OH﹣存在的条件下发生水解反应:
O2NC6H4COOC2H5+OH﹣O2NC6H4COOO﹣+C2H5OH
两种反应物的初始浓度均为0.050molL﹣1 , 某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如下表所示:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
α/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
回答下列问题:①该反应在330s~530s的平均反应速率为(只列算式,不做运算)
②为提高O2NC6H4COOC2H5的转化率,可以采取的措施有 . (写1条即可)
(3)2015年8月12日天津港爆炸中有一定量的氰化物泄露,可用如图2所示装置除去含CN﹣、Cl﹣废水中的CN﹣ , 控制溶液pH为9~10,阳极产生的ClO﹣将CN﹣氧化为两种无污染的气体,该反应的离子方程式为 , 其中两个电极的材料分别为石墨和铁,则石墨作极,其电极反应式为 .
【答案】
(1)减小;NO2(g)+CO(g)=NO(g)+CO2(g)△H=﹣228.7KJ/mol
(2)![]() ;增加OH﹣的浓度、移去产物
;增加OH﹣的浓度、移去产物
(3)2CN﹣+5ClO﹣+H2O═N2↑+2CO2↑+5Cl﹣+2OH﹣;阳;Cl﹣+2OH﹣﹣2e﹣═ClO﹣+H2O
【解析】解:(1.)若在反应体系中加入催化剂,能降低反应的活化能,反应速率增大,则E1减小,图象分析可知一定温度下1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中,反应的焓变△H=E1﹣E2=147.5KJ/mol﹣376.2kJ/mol﹣=﹣228.7KJ/mol,该反应的热化学方程式为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=﹣228.7KJ/mol,所以答案是:减小,NO2(g)+CO(g)=NO(g)+CO2(g)△H=﹣228.7KJ/mol;
(2.)①该反应在330s~530s的平均反应速率= ![]() ,
,
所以答案是; ![]() ;
;
②为提高O2NC6H4COOC2H5的平衡转化率,可使平衡向正向移动,可增加OH﹣的浓度、移去产物,所以答案是:增加OH﹣的浓度、移去产物;
(3.)阳极产生的ClO﹣将CN﹣氧化为两种无污染的气体,两种气体为二氧化碳和氮气,该反应在碱性条件下进行,所以应该有氢氧根离子生成,反应方程式为2CN﹣+5ClO﹣+H2O═N2↑+2CO2↑+5Cl﹣+2OH﹣ , 该电解质溶液呈碱性,电解时,用不活泼金属或导电非金属作负极,可以用较不活泼金属作正极,石墨做阳极,阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl﹣+2OH﹣﹣2e﹣═ClO﹣+H2O,所以答案是:2CN﹣+5ClO﹣+H2O═N2↑+2CO2↑+5Cl﹣+2OH﹣ , 阳,Cl﹣+2OH﹣﹣2e﹣═ClO﹣+H2O.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).