题目内容
【题目】已知岩脑砂的主要成分为NH4Cl,实验室可通过过量氨气和氯气反应制NH4Cl。
I.实验室制NH4Cl

(1)写出B中反应的离子方程式_________________________________。
(2)为使氨气和氯气在D中充分混合并反应,上述装置的连接顺序为a→d→c_____、______←j←i←h←g←b;写出D中反应的化学方程式_________________________________。
(3)若要检验NH4Cl,除蒸馏水、稀HNO3、AgNO3溶液、红色石蕊试纸外还需要的试剂为___________。
Ⅱ:天然岩脑砂中NH4Cl,纯度的测定(杂质不影响NH4Cl纯度测定)
已知:2NH4 C1+3CuO![]() 3Cu+2HC1↑+N2↑+3H2O
3Cu+2HC1↑+N2↑+3H2O
实验步骤:①准确称取1.19g岩脑砂。②将岩脑砂与足量氧化铜混合加热(装置如下)。
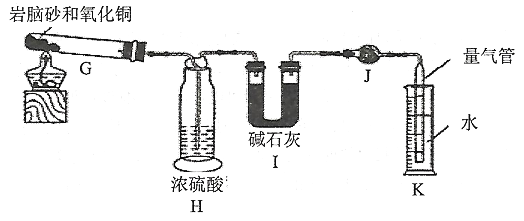
(1)连接仪器,检查装置气密性:先将K中装入水,然后加热G,______________________,则气密性良好。
(2)H中浓硫酸的作用是_________________________________。
(3)实验结束后,恢复至原温,通过K测得气体体积为224mL(换算为标准状况),则天然岩脑砂中NH4C1的纯度为___________。(保留三位有效数字)
(4)某同学通过测I的增重来计算天然岩脑砂中NH4C1的质量分数,则所得NH4C1的纯度___________。(填“偏高”、“偏低”、“无影响”)
【答案】![]() e f
e f ![]() 氢氧化钠浓溶液 量气管末端有气泡冒出,停止加热,量气管内形成一段水柱 吸收反应产生的水蒸气,防止对HCl测定造成干扰 89.9% 偏低
氢氧化钠浓溶液 量气管末端有气泡冒出,停止加热,量气管内形成一段水柱 吸收反应产生的水蒸气,防止对HCl测定造成干扰 89.9% 偏低
【解析】
I. 实验室制NH4Cl需要分别制备氨气和氯气,A装置中用氯化铵和氢氧化钙加热制备氨气,装置C碱石灰干燥氨气,装置B中二氧化锰与浓盐酸加热制备氯气,用装置F干燥氯气,氨气的密度小、氯气密度大,为使氨气和氯气充分混合,通过f通入氯气、通过e通入氨气; D中氨气和氯气反应生成氮气和氯化铵;检验固体氯化铵中的铵根离子需要氢氧化钠浓溶液和红色石蕊试纸,检验氯离子需要蒸馏水、硝酸银和稀硝酸。Ⅱ:(1) 若气密性良好,导管和量气管末端有气泡冒出,停止加热,量气管内形成一段水柱;(2)H中浓硫酸,能够吸收混合气体中的水蒸气,防止对HCl测定造成干扰;(3) K中收集到的气体是氮气,根据氮气的体积可以计算NH4C1的质量。(4)反应生成的氯化氢不能完全被I吸收。
I. (1)装置 B中二氧化锰与浓盐酸加热生成氯化锰、氯气和水,反应的离子方程式是![]() ;(2)制取氨气的气流顺序为a→d→c,制取氯气的气流顺序为b→g→h→i→j,考虑到氯气的密度比空气大,氨气的密度比空气小,所以氨气从e口进,氯气从f口进,氨气和氯气会形成逆向流动,更有利于二者充分混合,合理的连接顺序为a→d→c→e、f←j←i←h←g←b。D中氨气和氯气反应生成氮气和氯化铵,反应方程式是
;(2)制取氨气的气流顺序为a→d→c,制取氯气的气流顺序为b→g→h→i→j,考虑到氯气的密度比空气大,氨气的密度比空气小,所以氨气从e口进,氯气从f口进,氨气和氯气会形成逆向流动,更有利于二者充分混合,合理的连接顺序为a→d→c→e、f←j←i←h←g←b。D中氨气和氯气反应生成氮气和氯化铵,反应方程式是![]() ; (3)检验固体氯化铵中的铵根离子需要氢氧化钠浓溶液和红色石蕊试纸,检验氯离子需要蒸馏水、硝酸银和稀硝酸,所以还需要的试剂为氢氧化钠浓溶液。Ⅱ:(1)连接好仪器后,检查装置的气密性时,先将H和K中装入蒸馏水,然后加热G,量气管末端有气泡冒出,停止加热,量气管内形成一段水柱,则气密性良好。(2)产生的气体通过装置H中的浓硫酸,能够吸收混合气体中的水蒸气,防止对HCl测定造成干扰,减小实验误差。(3) K中收集到的气体是氮气,标准状况下,224mL氮气的物质的量是0.01mol,根据反应2NH4Cl+3CuO
; (3)检验固体氯化铵中的铵根离子需要氢氧化钠浓溶液和红色石蕊试纸,检验氯离子需要蒸馏水、硝酸银和稀硝酸,所以还需要的试剂为氢氧化钠浓溶液。Ⅱ:(1)连接好仪器后,检查装置的气密性时,先将H和K中装入蒸馏水,然后加热G,量气管末端有气泡冒出,停止加热,量气管内形成一段水柱,则气密性良好。(2)产生的气体通过装置H中的浓硫酸,能够吸收混合气体中的水蒸气,防止对HCl测定造成干扰,减小实验误差。(3) K中收集到的气体是氮气,标准状况下,224mL氮气的物质的量是0.01mol,根据反应2NH4Cl+3CuO![]() 3Cu+2HCl↑+N2↑+3H2O可知,消耗氯化铵的量为0.02 mol,质量为0.02 mol×53.5 g/mol=1.07 g,则天然岩脑砂中NH4Cl的质量分数为1.07 g/1.19 g×100%=89.9%。(4) 反应生成的氯化氢不能完全被I吸收,所以通过测I的增重来计算天然岩脑砂中NH4C1的质量分数,结果会偏低。
3Cu+2HCl↑+N2↑+3H2O可知,消耗氯化铵的量为0.02 mol,质量为0.02 mol×53.5 g/mol=1.07 g,则天然岩脑砂中NH4Cl的质量分数为1.07 g/1.19 g×100%=89.9%。(4) 反应生成的氯化氢不能完全被I吸收,所以通过测I的增重来计算天然岩脑砂中NH4C1的质量分数,结果会偏低。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】(1)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:①C(s)+O2(g)===CO2(g);ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g);ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g);ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式__________________________
(2)在2 L固定体积的密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①写出该反应的平衡常数表达式:K=_______________________。已知:K300℃>K350℃,则该反应是______反应(填“放热”或“吸热”)。
②下图表示NO2的变化的曲线是__________。用O2表示从0~2 s内该反应的平均速率v=__________。
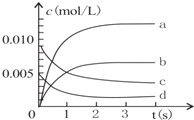
③能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
④为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂