题目内容
【题目】为了除去KNO3固体中含有的少量CaSO4、MgSO4,限选用三种试剂,按下列步骤操作:
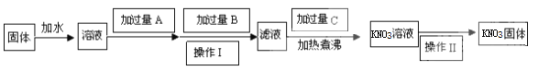
(1)写出下列两种试剂的化学式:A____,C____。
(2)根据题意,回答下列问题:
①加入过量A的主要目的是____,
②加热煮沸的目的是___。
(3)操作Ⅰ是____,操作Ⅱ主要是____。
【答案】Ba(OH)2 HNO3 除尽Mg2+和SO42- 使HNO3挥发 过滤 蒸发浓缩、冷却结晶
【解析】
除去溶液中的可溶性杂质,常加入沉淀剂使其转化为难溶物,再过滤除去。为除尽杂质离子,沉淀剂必须过量;多余的沉淀剂必须在后面的步骤中去除。
(1)固体溶于水所得溶液中杂质离子有Ca2+、Mg2+、SO42-,可分别转化为CaCO3、Mg(OH)2、BaSO4沉淀。为减少新杂质,沉淀剂分别是K2CO3、KOH、Ba(NO3)2,其中KOH、Ba(NO3)2可用Ba(OH)2代替。过量的Ba2+可转化为BaCO3沉淀除去,故K2CO3需在Ba(NO3)2或Ba(OH)2之后加入。过滤后,向滤液中加入稀HNO3可除去多余的OH-、CO32-。限选三种试剂,则A为Ba(OH)2溶液,B为K2CO3溶液,C为HNO3溶液。
(2)①样品溶液中加入过量A[Ba(OH)2溶液],使杂质离子Mg2+、SO42-完全转化为沉淀;
②滤液中加过量稀HNO3后,加热煮沸可使多余的HNO3挥发除去。
(3)从流程图中操作I、II前后的物质看,操作Ⅰ是过滤,操作Ⅱ主要是蒸发浓缩、冷却结晶

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目