题目内容
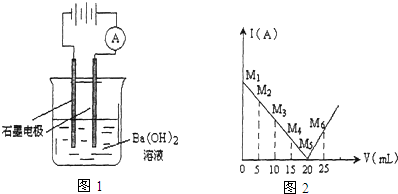
7.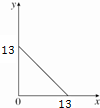 某温度(T℃)下的溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
某温度(T℃)下的溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:(1)该温度T>25℃(填“>”、“<”或“=”).
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示.
| 实验 序号 | Ba(OH)2溶液 的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 9 |
| ② | 22.00 | 18.00 | b |
| ③ | 22.00 | 22.00 | 6 |
(3)在此温度下,将10mL 0.1mol•L-1的Ba(OH)2溶液分别与5mL 0.1mol•L-1的NaHSO4溶液混合,所得溶液的pH为12.如果将等浓度等体积的Ba(OH)2溶液与NH4Cl溶液混合,所得溶液中各离子浓度由大到小的排列顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
分析 (1)由图象可知,x=0时,y=13,y=0时,x=13,则有x+y=13,升高温度水的离子积常数增大,据此判断温度高低;
(2)c[Ba(OH)2]=$\frac{1}{2}$c(OH-)=$\frac{1}{2}$×$\frac{1{0}^{-13}}{1{0}^{-9}}$mol/L=5×10-5mol/L,③等体积混合时混合溶液pH=6.5,混合溶液呈中性,n(H+)=n(OH-),据此计算a;
混合溶液中c(OH-)=$\frac{1{0}^{-4}×(0.022-0.018)}{0.022+0.018}$mol/L,pH=-lgc(H+);
(3)混合溶液中c(OH-)=$\frac{0.1mol/L×2×0.01L-0.1mol/L×0.005L}{0.01L+0.005L}$,混合溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$,pH=-lgc(H+);
如果将等浓度等体积的Ba(OH)2溶液与NH4Cl溶液混合,二者物质的量相等,溶质为等物质的量浓度的Ba(OH)2、NH3.H2O、BaCl2,一水合氨是弱电解质,在水溶液中部分电离,结合电荷守恒判断离子浓度大小.
解答 解:(1)由图象可知,x=0时,y=13,y=0时,x=13,则有x+y=13,则水的离子积常数=10-x.10-y=10-13>10-14,升高温度水的离子积常数增大,所以该温度>25℃,故答案为:>;
(2)c[Ba(OH)2]=$\frac{1}{2}$c(OH-)=$\frac{1}{2}$×$\frac{1{0}^{-13}}{1{0}^{-9}}$mol/L=5×10-5mol/L,③等体积混合时混合溶液pH=6.5,混合溶液呈中性,n(H+)=n(OH-),二者体积相等,则c(H+)=c(OH-)=10-4mol/L,则a=4;
混合溶液中c(OH-)=$\frac{1{0}^{-4}×(0.022-0.018)}{0.022+0.018}$mol/L=10-5mol/L,pH=-lgc(H+)=-lg$\frac{1{0}^{-13}}{1{0}^{-5}}$=8,
故答案为:4;8;
(3)混合溶液中c(OH-)=$\frac{0.1mol/L×2×0.01L-0.1mol/L×0.005L}{0.01L+0.005L}$=0.1mol/L,混合溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-13}}{0.1}$mol/L=10-12mol/L,pH=-lgc(H+)=-lg10-12=12;
如果将等浓度等体积的Ba(OH)2溶液与NH4Cl溶液混合,二者物质的量相等,溶质为等物质的量浓度的Ba(OH)2、NH3.H2O、BaCl2,一水合氨是弱电解质,在水溶液中部分电离,溶液呈碱性,一水合氨、氢氧化钡和水都电离生成氢氧根离子,所以c(OH-)最大,根据物料守恒得c(Ba2+)=c(Cl-),一水合氨电离程度大于水电离程度,所以c(NH4+)>c( H+),则溶液中离子浓度大小顺序是c( OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c( H+),
故答案为:12; c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
点评 本题考查酸碱混合溶液定性判断,为高频考点,正确判断溶液离子积常数、溶液pH计算方法是解本题关键,难点是离子浓度大小比较,注意电荷守恒和物料守恒的应用.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | 托盘上各放一张滤纸,然后在右盘上添加2g砝码,称取2.0gNaOH固体 | |
| B. | 大量氯气泄漏时,用肥皂水浸湿毛巾捂住嘴和鼻,并迅速离开现场 | |
| C. | 向沸水中边滴加FeCl3溶液边用玻璃棒搅拌,可制得Fe(OH)3胶体 | |
| D. | 用规格为10 mL的量筒量取6.20 mL的液体 |
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与稀硝酸反应:2Fe3O4+18H+═6Fe3++H2↑+ 8H2O | 正确 |
| B | 向碳酸镁中加稀盐酸:CO${\;}_{3}^{2-}$+2H+═CO2↑+ H2O | 错误,碳酸镁不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+ Br2 | 错误,Fe2+与Br-的化学计量数之比应为1:2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 溴元素只存在于海洋中,故溴被称为“海洋元素” | |
| B. | 硅单质是一种半导体材料,也常用于制造光导纤维 | |
| C. | 钠在盛有氯气的集气瓶中燃烧,火焰呈苍白色,瓶口有白烟 | |
| D. | 工业炼铁过程加入石灰石的作用是除脉石(SiO2)造渣 |