题目内容
17.下列叙述正确的是( )| A. | 托盘上各放一张滤纸,然后在右盘上添加2g砝码,称取2.0gNaOH固体 | |
| B. | 大量氯气泄漏时,用肥皂水浸湿毛巾捂住嘴和鼻,并迅速离开现场 | |
| C. | 向沸水中边滴加FeCl3溶液边用玻璃棒搅拌,可制得Fe(OH)3胶体 | |
| D. | 用规格为10 mL的量筒量取6.20 mL的液体 |
分析 A.称量药品时遵循“左物右砝”原则,且称量强腐蚀性固体药品应该放置在烧杯中;
B.氯气有毒,能够与碱性溶液反应生成无毒的物质;
C.制取氢氧化铁胶体时不能搅拌;
D.量筒的感量是0.1mL.
解答 解:A.称量药品时遵循“左物右砝”原则,且称量强腐蚀性固体药品应该放置在烧杯中,NaOH具有强腐蚀性,所以应该放置在烧杯中称量,且NaOH要放置在左盘、砝码放置在右盘,故A错误;
B.氯气有毒,能够与碱性溶液反应生成无毒的物质,所以大量氯气泄漏时,用肥皂水浸湿毛巾捂住嘴和鼻子,并迅速离开现场,故B正确;
C.制取氢氧化铁胶体时不能搅拌,否则易产生氢氧化铁沉淀,故C错误;
D.量筒的感量是0.1mL,滴定管的感量是0.01mL,所以用滴定管量取6.20 mL的液体,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器使用、药品保存、胶体制备等知识点,明确实验原理、物质制备方法、物质性质是解本题关键,注意从实验基本操作、物质性质来分析评价,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
7.某温度下,可逆反应mA(g)+nB(g)?pC(g)的平衡常数为K,下列对K的说法正确的是( )
| A. | K值越大,表明该反应速率越快,反应物的转化率也越大 | |
| B. | 若缩小反应器的容积,能使平衡正向移动,则K增大 | |
| C. | 温度相同,K值也一定相同 | |
| D. | pC(g)?mA(g)+nB(g) 的平衡常数与K互为相反数 |
8.25℃时,某溶液由H2O电离产生的c(H+)=10-13mol•L-1,则下列离子组在该溶液中一定能大量共存的是( )
| A. | Na+、K+、Cl-、SO42- | B. | Na+、HCO3-、SO42-、Cl- | ||
| C. | Fe2+、K+、SO42-、NO3- | D. | K+、NH4+、SO42-、Cl- |
5.海水开发利用的部分过程如图所示.下列说法不正确的是( )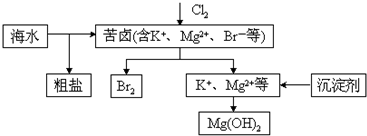

| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 工业生产常选用NaOH作为沉淀剂 | |
| C. | 粗盐可采用除杂和重结晶等过程提纯 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
12.具有下列电子层结构的原子,其对应元素一定属于同一周期的是( )
| A. | 两种原子的电子层上全部都是s电子 | |
| B. | 3p能级上只有一个空轨道的原子和3p能级上有一个未成对电子的原子 | |
| C. | 最外层电子排布式为2s22p6的原子和最外层电子排布式为2s22p6的离子 | |
| D. | 原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子 |
9.某雨水样品刚采集时测得pH为4.82,放在烧杯中经2小时后,再次测得pH为4.68.以下叙述正确的是( )
| A. | 雨水样品酸性逐渐减小 | |
| B. | 雨水样品酸性没有变化 | |
| C. | 雨水样品pH降低的原因可能是继续吸收空气中的CO2 | |
| D. | 雨水样品中的pH降低的原因可能是H2SO3逐渐被氧气氧化成H2SO4 |
7.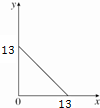 某温度(T℃)下的溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
某温度(T℃)下的溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
(1)该温度T>25℃(填“>”、“<”或“=”).
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示.
假设溶液混合前后的体积变化忽略不计,则a=4,实验②中b=8.
(3)在此温度下,将10mL 0.1mol•L-1的Ba(OH)2溶液分别与5mL 0.1mol•L-1的NaHSO4溶液混合,所得溶液的pH为12.如果将等浓度等体积的Ba(OH)2溶液与NH4Cl溶液混合,所得溶液中各离子浓度由大到小的排列顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
 某温度(T℃)下的溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
某温度(T℃)下的溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:(1)该温度T>25℃(填“>”、“<”或“=”).
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示.
| 实验 序号 | Ba(OH)2溶液 的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 9 |
| ② | 22.00 | 18.00 | b |
| ③ | 22.00 | 22.00 | 6 |
(3)在此温度下,将10mL 0.1mol•L-1的Ba(OH)2溶液分别与5mL 0.1mol•L-1的NaHSO4溶液混合,所得溶液的pH为12.如果将等浓度等体积的Ba(OH)2溶液与NH4Cl溶液混合,所得溶液中各离子浓度由大到小的排列顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).