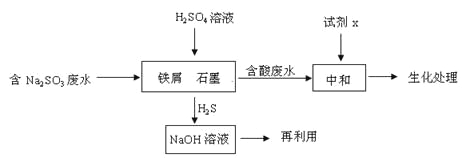
题目内容
【题目】某研究性学习小组设计了一组实验验证元素周期律。
(1)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。甲同学设计该实验的目的是_________________,反应最剧烈的烧杯是________(填字母),结论是__________,原因(从本质上解释)______________。
(2)乙同学想验证同周期元素金属性强弱的规律,最好选用第________周期的________三种元素(填元素名称)。最简单的实验是将大小相近的三小块金属分别投入相同浓度的稀盐酸中,观察现象。解释:___________________。写出钠和水反应的离子方程式__________________________
(3)丙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。他设计了如图的装置以验证氮、碳、硅元素的非金属性强弱。丙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
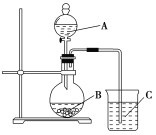
①写出所选用物质的化学式:A:________,B:________,C:________。
②写出烧杯中发生反应的离子方程式:_________________。
③该实验存在的问题是___________________,改进措施为___________________________
【答案】验证锂、钠、钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强) c 锂、钠、钾的活泼性依次增强 同一主族,从上至下,原子半径逐渐增大,原子核吸引最外层电子的能力减弱,原子失去电子的能力逐渐增强 三 钠、镁、铝 同一周期从左至右,原子半径逐渐减小,核电荷数逐渐增大,原子核吸引最外层电子的能力逐渐增强,失去电子的能力减弱,故金属性逐渐减弱 2Na+2H2O═2Na++2OH-+H2↑ HNO3 CaCO3 Na2SiO3(或K2SiO3) CO2+SiO32-+H2O=H2SiO3↓+CO32-或2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3- 硝酸具有挥发性,无法确定与硅酸钠反应的是二氧化碳还是挥发出的硝酸 在B和C之间增加一个盛放饱和NaHCO3洗气装置
【解析】
(1)由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱;金属性越强,单质与水反应越剧烈;
(2)验证同周期元素金属性强弱的规律,最好选用第3周期的钠、镁、铝三种元素,因为与第2、4、5、6周期相比较,第3周期元素的变化规律较典型;
(3)利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,A为硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,以此解答。
(1)由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱;同一主族,从上至下,原子半径逐渐增大,原子核吸引最外层电子的能力减弱,原子失去电子的能力逐渐增强,所以金属性K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是c;故答案为:验证锂、钠、钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强);c;锂、钠、钾的活泼性依次增强;同一主族,从上至下,原子半径逐渐增大,原子核吸引最外层电子的能力减弱,原子失去电子的能力逐渐增强;
(2)验证同周期元素金属性强弱的规律,最好选用第三周期的钠、镁、铝三种元素,因为与第2、4、5、6周期相比较,第三周期元素的变化规律较典型;同一周期从左至右,原子半径逐渐减小,核电荷数逐渐增大,原子核吸引最外层电子的能力逐渐增强,失去电子的能力减弱,故金属性逐渐减弱,所以三种金属中钠最活泼,遇水就剧烈反应,与盐酸反应更剧烈,产生大量热,放出H2,铝金属活动性最弱,与酸反应比镁要缓慢,但也能产生大量气泡,镁与酸剧烈反应,产生大量气泡;故答案为:三;钠、镁、铝;同一周期从左至右,原子半径逐渐减小,核电荷数逐渐增大,原子核吸引最外层电子的能力逐渐增强,失去电子的能力减弱,故金属性逐渐减弱;2Na+2H2O═2Na++2OH-+H2↑;
(3)①乙同学的实验是利用强酸制弱酸的原理,非金属性越强,其最高价氧化物对应水化物的酸性越强。由题意可推测,A为HNO3,B为CaCO3,C为Na2SiO3;烧杯中二氧化碳与硅酸钠反应生成硅酸沉淀,其反应离子方程式为:CO2+SiO32-+H2O═H2SiO3↓+CO32-或2CO2+SiO32-+2H2O═H2SiO3↓+2HCO3-,故答案为:HNO3;CaCO3;Na2SiO3;
②根据①可知答案为:CO2+SiO32-+H2O═H2SiO3↓+CO32-或2CO2+SiO32-+2H2O═H2SiO3↓+2HCO3-.
③因硝酸易挥发,则生成的二氧化碳气体中混有硝酸蒸气,硝酸也能与硅酸钠产生白色沉淀,干扰实验的验证,则应用饱和碳酸氢钠除去硝酸,故答案为:硝酸具有挥发性,无法确定与硅酸钠反应的是二氧化碳还是挥发出的硝酸;在B和C之间增加一个盛放饱和NaHCO3洗气装置。