题目内容
19.四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,Y、W同主族且能形成两种常见的化合物,X、W质子数之和是Z质子数的2倍.则下列说法中正确的是( )| A. | 原子半径比较:X<Y<Z<W | |
| B. | X的氢化物沸点一定低于Y的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
分析 X元素的原子,其最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,故X是碳元素;
Y、W同主族且能形成两种常见的化合物,且原子序数W>Y,则Y为O元素、W为S元素,形成2种常见化合物分别为二氧化硫和三氧化硫;
X、W质子数之和是Z质子数的2倍,则(6+16)÷2=11,即Z为钠元素,据此判断即可.
解答 解:X元素的原子,其最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,故X是碳元素;
Y、W同主族且能形成两种常见的化合物,且原子序数W>Y,则Y为O元素、W为S元素,形成2种常见化合物分别为二氧化硫和三氧化硫;
X、W质子数之和是Z质子数的2倍,则(6+16)÷2=11,即Z为钠元素,
A、电子层数越多,半径越大,同一周期,原子序数越小,半径越大,即原子半径:Na>S>C>O,故A错误;
B、X可以形成多种氢化物,即烃,如十七烷等,沸点高于水,故B错误;
C、由于非金属性O>S,故稳定性H2O>H2S,故C错误;
D、元素的金属性越强,其对应最高价氧化物的水化物的碱性越强,由于金属性Na最强,故NaOH碱性最强,故D正确,故选D.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.化学与生产生活、环境保护、资源利用、能源开发等密切相关.下列说法错误的是( )
| A. | “地沟油”禁止食用,但可以用来做燃料 | |
| B. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |
4.下列各组离子在溶液中能够大量共存的是( )
| A. | NH4+、Cl-、Na+、SO42- | B. | Na+、Ba2+、OH-、SO42- | ||
| C. | Ca2+、H+、S2-、ClO- | D. | H+、Cl-、Fe2+、NO3- |
11.下列离子方程式书写正确的是( )
| A. | KMnO4溶液用盐酸酸化并加入H2O2:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O | |
| B. | Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42-+Ba2++3OH-=BaSO4↓+Fe(OH)3↓ | |
| C. | 等体积等物质的量浓度的AlCl3、Ba(OH)2、HCl溶液混合:3H++Al3++6OH-=Al(OH)3↓+3H2O | |
| D. | 水玻璃与稀醋酸混合:SiO32-+2H+=H2SiO3↓ |
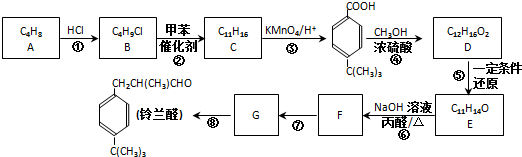
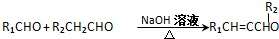
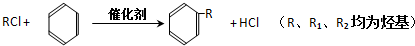
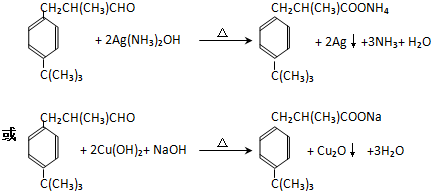 .
.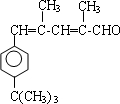 .
.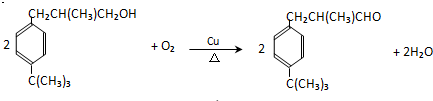 .
.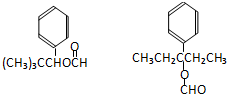 .
. CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.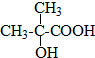 B的结构简式
B的结构简式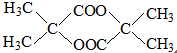 .
.