题目内容
7.利用生活中或实验室中常用的物品(电极材料、导线、电解质溶液、电流计),根据实验原理:Zn+2H+═Zn2++H2↑,根据选取材料自己动手设计一个原电池.(1)选取的负极材料为锌片,电解液为稀硫酸:
(2)电子由负极经外电路流向正极(填“正和负”)
(3)负极的电极反应式:Zn-2e-=Zn2+.
(4)正极发生还原(“氧化”或“还原”)反应,周围会出现的现象是有气泡产生.
分析 根据电池反应式知,Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,
(1)失电子化合价升高的金属单质作负极,得电子化合价降低的电解质溶液为电解液;
(2)电子从负极沿导线流向正极;
(3)负极上失电子发生氧化反应;
(4)正极上得电子发生还原反应,该原电池中正极上氢离子得电子生成氢气.
解答 解:根据电池反应式知,Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,
(1)失电子化合价升高的金属单质作负极,得电子化合价降低的电解质溶液为电解液,根据电池反应式知,Zn失电子作负极,稀硫酸是电解质溶液,
故答案为:锌片;稀硫酸;
(2)负极上失电子、正极上得电子,所以电子从负极沿导线流向正极,故答案为:负;正;
(3)负极上失电子发生氧化反应,根据电池反应式知,负极上Zn失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(4)该原电池中正极上氢离子得电子生成氢气,所以正极上发生还原反应,看到的现象是有气泡生成,
故答案为:还原;有气泡产生.
点评 本题考查原电池设计,侧重考查原电池原理及知识运用能力,原电池反应中化合价升高的金属单质作负极、得电子的可溶性电解质溶液为原电池电解质溶液,题目难度不大.

练习册系列答案
相关题目
7.元素周期表是化学学习和科学研究的重要工具,下列对于元素周期表的使用方法不正确的是( )
| A. | 为新元素的发现及预测它们的原子结构和性质提供线索 | |
| B. | 利用元素周期表发现元素的种类和原子的种类相同 | |
| C. | 在周期表中金属与非金属的分界处,可寻找半导体材料 | |
| D. | 指导人们在过渡元素中寻找催化剂和耐高温.耐腐蚀的合金材料 |
15.CuCl2常用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂.工业上用粗制的氧化铜粉末(含FeO和SiO2杂质)来制取无色CuCl2的流程如下: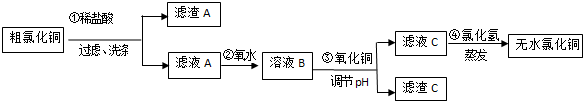
已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表
(1)第②步反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(2)滤渣A的成分有SiO2(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取少量滤液C于试管中,向其中加入硫氰化钾溶液,溶液变血红色,证明滤液C中Fe3+未除尽,反之未除尽.
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒,需要在氯化氢气流中蒸干制取无水氯化铜的原因是氯化氢可抑制氯化铜的水解;
(4)称取30.250g已制得的无水CuCl2产品(含0.0204molFeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤.得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol•L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为0.89(用小数表示,计算结果保留2位小数).

已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
(2)滤渣A的成分有SiO2(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取少量滤液C于试管中,向其中加入硫氰化钾溶液,溶液变血红色,证明滤液C中Fe3+未除尽,反之未除尽.
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒,需要在氯化氢气流中蒸干制取无水氯化铜的原因是氯化氢可抑制氯化铜的水解;
(4)称取30.250g已制得的无水CuCl2产品(含0.0204molFeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤.得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol•L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为0.89(用小数表示,计算结果保留2位小数).
2.下列措施对增大反应速率明显有效的是( )
| A. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| B. | Fe与稀硫酸反应制取H2时,改用浓硫酸 | |
| C. | Al在氧气中燃烧生成A12O3,将Al片改成Al粉 | |
| D. | Na与水反应时增大水的用量 |
12.臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)?N2O5(g)+O2(g).若此反应在恒容密闭容器中进行,相关图象如下列选项,其中对应分析结论正确的是( )
| A. | B. | C. | D. |
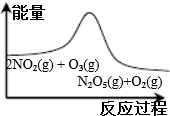 | 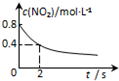 |  | 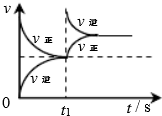 |
| 平衡后升温, NO2含量降低 | 0~2s内, v(O3)=0.2 mol•L-1•s-1 | V正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
| A. | A | B. | B | C. | C | D. | D |
19.四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,Y、W同主族且能形成两种常见的化合物,X、W质子数之和是Z质子数的2倍.则下列说法中正确的是( )
| A. | 原子半径比较:X<Y<Z<W | |
| B. | X的氢化物沸点一定低于Y的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
17.下列有关晶体的说法中正确的是( )
| A. | 氯化钾溶于水时离子键未被破坏 | B. | 原子晶体中共价键越强,熔点越高 | ||
| C. | 冰融化时分子中共价键发生断裂 | D. | 分子间作用力越大,分子越稳定 |
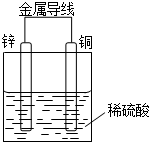 某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告
某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告