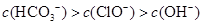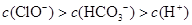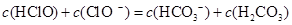题目内容
下列事实一定能证明HNO2是弱电解质的是( )
| A.用HNO2溶液做导电实验,灯泡很暗; | B.0.1 mol/L HNO2溶液的pH=2.1 |
| C.HNO2不是离子化物,而是共价化合物 | D.HNO2和NaCl不能发生反应 |
B
试题分析:A项溶液导电性强弱与溶液中的离子浓度和离子所带电荷有关,与电解质的强弱无关,B项0.1 mol/L HNO2溶液的pH=2.1,说明HNO2没有完全电离,可以证明是弱电解质,C项共价化合物也有强电解质,如HCl,D项不能用是否发生化学反应来判断强弱电解质。答案选B。
点评:弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在,就证明了弱电解质。弱酸 CH3COOH的证明方法有:①测定一定浓度的CH3COOH溶液的pH值;②测定一定浓度的CH3COONa溶液的pH值;③将一定pH值的CH3COOH溶液稀10n 倍后,测定pH值;④测定相同浓度的CH3COOH溶液和HCl溶液的导电性,比较导电性强弱;⑤测定一定等pH值CH3COOH溶液与HCl溶液,稀释相同倍数倍后pH值的改变;⑥用等物质的量浓度的CH3COOH与HCl分别与锌反应,看产生气泡的速率;⑦用等pH值等体积的CH3COOH溶液与HCl溶液分别与足量的锌反应,测定生成氢气的体积。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
 CH3OH(g),现在实验室模拟该反应并进行分析。
CH3OH(g),现在实验室模拟该反应并进行分析。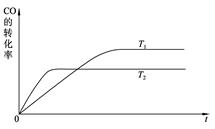


 NH4++NH2—的电离平衡关系,两离子的平衡浓度均为1×10—15mol/L,下列对-50℃时液氨的离子积表达正确的是
NH4++NH2—的电离平衡关系,两离子的平衡浓度均为1×10—15mol/L,下列对-50℃时液氨的离子积表达正确的是 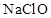 、
、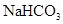 混合溶液中,各种离子浓度关系正确的是 ( )
混合溶液中,各种离子浓度关系正确的是 ( )