题目内容
已知室温时0.1mo1/L某一元酸HA在水中有0.1%发生电离,叙述错误的是:
| A.该溶液的pH=4 | B.升高温度,溶液的KW增大 |
| C.此酸的电离平衡常数约为1×10-7 | D.该溶液里不存在HA分子 |
D
试题分析:
HA
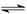 H+ + A-
H+ + A-始(mol/L)0.1
变(mol/L)0.1×0.1%=10-4 10-4 10-4
平(mol/L)0.0999 10-4 10-4
溶液中氢离子浓度为10-4mo1/L,pH=4,A正确;水的电离过程是吸热过程,升高温度,促进水的电离,Kw增大,B正确;此酸的电离常数K=c(H+)c(A-)/c(HA)≈10-7,C正确;酸部分电离,所以溶液中还有未电离的HA分子,D错误。
点评:弱电解质电离平衡计算与化学平衡计算模式相同。

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
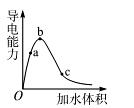
 CH3COOH + OH—的平衡中,要使水解平衡向右移动,应采取的措施是
CH3COOH + OH—的平衡中,要使水解平衡向右移动,应采取的措施是
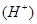 由小到大的顺序是 。
由小到大的顺序是 。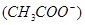 增大,c
增大,c 的醋酸溶液加水稀释时,下列说法正确的是( )
的醋酸溶液加水稀释时,下列说法正确的是( ) 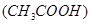 减小,电离平衡向生成醋酸分子的方向移动?
减小,电离平衡向生成醋酸分子的方向移动?  也增大了
也增大了 H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
 )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力,
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力, 。
。 约为___ _%。
约为___ _%。 = Ka(HF)
= Ka(HF)