题目内容
(16分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g)  CH3OH(g),现在实验室模拟该反应并进行分析。
CH3OH(g),现在实验室模拟该反应并进行分析。
(1)下列各项中,不能够说明该反应已达到平衡的是__________(填序号)。
A. 恒温、恒容条件下,容器内的压强不发生变化
B. 一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
C. 一定条件下,CO、H2和CH3OH的浓度保持不变
D. 一定条件下,单位时间内消耗2 mol CO,同时生成1 mol CH3OH
(2) 右图是该反应在不同温度下CO的转化率随时间变化的曲线。
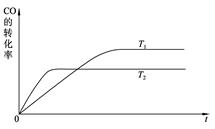
① 该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
② T1和T2温度下的平衡常数大小关系是K1_______K2
(填 “>”、“<”或“=”)。
③ 若容器容积不变,下列措施可增加甲醇产率的是
______________。
A. 升高温度 B. 将CH3OH(g)从体系中分离
C. 使用合适的催化剂
D. 充入He,使体系总压强增大
(3)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,甲醇燃料电池的工作原理如右图所示。

①请写出c口通入的物质发生的相应电极反应式_________ 。
②工作一段时间后,当0.2 mol甲醇完全反应生成CO2 时,有___________NA个电子转移。
(4)利用右装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开光K置于 处,该电化学防护法称为 。
 CH3OH(g),现在实验室模拟该反应并进行分析。
CH3OH(g),现在实验室模拟该反应并进行分析。(1)下列各项中,不能够说明该反应已达到平衡的是__________(填序号)。
A. 恒温、恒容条件下,容器内的压强不发生变化
B. 一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
C. 一定条件下,CO、H2和CH3OH的浓度保持不变
D. 一定条件下,单位时间内消耗2 mol CO,同时生成1 mol CH3OH
(2) 右图是该反应在不同温度下CO的转化率随时间变化的曲线。

① 该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
② T1和T2温度下的平衡常数大小关系是K1_______K2
(填 “>”、“<”或“=”)。
③ 若容器容积不变,下列措施可增加甲醇产率的是
______________。
A. 升高温度 B. 将CH3OH(g)从体系中分离
C. 使用合适的催化剂
D. 充入He,使体系总压强增大
(3)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,甲醇燃料电池的工作原理如右图所示。

①请写出c口通入的物质发生的相应电极反应式_________ 。
②工作一段时间后,当0.2 mol甲醇完全反应生成CO2 时,有___________NA个电子转移。
(4)利用右装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开光K置于 处,该电化学防护法称为 。
(1)D(2分)
(2) ① <(2分) ② >(2分) ③ B(2分)
(3)①O2+4e-+4H+=2H2O(2分); ② 1.2(2分)
(4)N(1分); M(1分)牺牲阳极的阴极保护法(或:牺牲阳极保护法)(2分)
(2) ① <(2分) ② >(2分) ③ B(2分)
(3)①O2+4e-+4H+=2H2O(2分); ② 1.2(2分)
(4)N(1分); M(1分)牺牲阳极的阴极保护法(或:牺牲阳极保护法)(2分)
试题分析:(1)判断反应到达平衡的条件是:反应物和生成物均在同一反应体系中,反应条件保持不变;质量(浓度)保持不变,V顺=V逆。
(2)①先拐先到达平衡,说明T2>T1,随着温度的升高,CO的转化率下降,说明反应向逆反应方向进行,故该反应放热反应,ΔH<0。
②因为ΔH<0且T1<T2,所以T1温度下CO的转化率要大于T2的,故K1>K2.
③定容情况下,各因素对化学反应的影响,因为放热反应,故升温反而降低了甲醇的产率;使用催化剂,只能改变反应效率,不能改变反应限度;充入He,使体系总压强增大,因为体积不变,故此做法对反应移动没影响。
(3)①H+往右边移动,说明右边为阴极,发生还原反应,有因为生成了水,故c口通入的物质为O2,发生的化学反应为O2+4e-+4H+=2H2O。
(4)若X为碳棒,为减缓铁的腐蚀,该装置应该为电解池,故开关K应置于N初;若X为锌,该装置为原电池,故开关K应置于M处。
点评:此题考核了学生对可逆反应的影响因素的掌握理解和原电池、电解池的工作原理。

练习册系列答案
相关题目
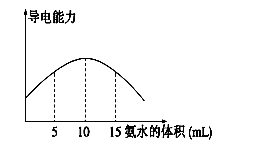
 时,溶液中随着水量的增加而减小的是
时,溶液中随着水量的增加而减小的是

 CH3COOH + OH—的平衡中,要使水解平衡向右移动,应采取的措施是
CH3COOH + OH—的平衡中,要使水解平衡向右移动,应采取的措施是