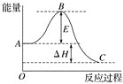
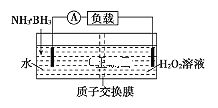
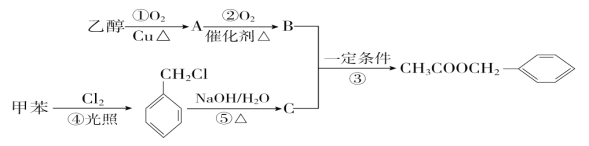
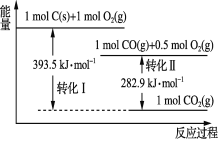
题目内容
【题目】研究金属与硝酸的反应,实验如下。
实验 (20C) | 现象 |
Ⅰ | 无色气体(遇空气变红棕色),溶液变为蓝色 |
Ⅱ | 6mL无色气体(经检测为H2),溶液几乎无色 |
⑴Ⅰ中产生的无色气体是______。
⑵研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是______。
![]() 乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
![]() 补全Ⅱ中NO3-被还原为
补全Ⅱ中NO3-被还原为![]() 的过程:NO3- + ______e- + ______= NH4+ + ______H2O
的过程:NO3- + ______e- + ______= NH4+ + ______H2O
⑶研究影响产生H2的因素
实验 | 现象 |
Ⅲ | 3.4m L气体(经检测为H2),溶液略带黄色 |
Ⅳ | 2.6m L气体(经检测为H2),黄色溶液 |
Ⅴ | 无色气体(遇空气变红棕色),深棕色溶液 |
资料:Fe[(NO)]2+在溶液中呈棕色。 ④对比Ⅱ、Ⅲ、Ⅳ,温度不同时收集到氢气的体积不同,原因是______。 ⑤Ⅴ中无色气体是混合气体,则一定含有遇空气变红棕色的气体和______。 ⑷根据实验,金属与硝酸反应时,影响硝酸的还原产物不同的因素有______。 【答案】NO 硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出 NO3-中氮元素的化合价为最高价,具有氧化性 取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体 8 10H+ 3 相同条件下,温度升高时,化学反应速率增大,但NO3-的还原速率增大的更多 H2 金属的种类、硝酸的浓度、温度 【解析】 ⑴Ⅰ中无色气体NO遇空气生成红棕色的二氧化氮气体。 ⑵①依据Ⅰ和Ⅱ硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中生成NO,因此可得NO3-没有发生反应不正确。 ②NO3-中氮元素的化合价为最高价,具有氧化性,证明NH4+的方法是去一定量溶液加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体。 ③根据化合价降低得到电子配平得到。 ⑶④根据现象和温度升高时,化学反应速率增大。 ⑤根据元素分析和前面的信息得到答案。 ⑷根据实验和几个反应现象得出答案。 ⑴Ⅰ中产生的无色气体遇空气变为红棕色,则为NO遇空气生成红棕色的二氧化氮气体; 故答案为:NO。 ⑵①依据Ⅰ和Ⅱ硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出,故认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应不正确,故答案为:硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出。 ②元素的最高级具有氧化性,故NO3-中氮元素的化合价为最高价,具有氧化性,推测出NO3-也能被还原;证实该溶液中含有NH4+的方法为:取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体,故答案为:NO3-中氮元素的化合价为最高价,具有氧化性;取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体。 ③NO3-被还原为NH4+的反应为:NO3- + 8e- + 10H+= NH4+ + 3H2O,故答案为:8;10H+;3。 ⑶④根据现象可得,Ⅱ、Ⅲ生成氢气,Ⅳ生成有NO,因为相同条件下,温度升高时,化学反应速率增大,但NO3-的还原速率增大的更多,故答案为:相同条件下,温度升高时,化学反应速率增大,但NO3-的还原速率增大的更多。 ⑤Ⅴ中无色气体是混合气体,根据元素分析,则一定含有遇空气变红棕色的NO气体和H2,故答案为:H2。 ⑷根据实验,金属与硝酸反应时,影响硝酸的还原产物不同的因素有金属的种类、硝酸的浓度、温度,故答案为:金属的种类、硝酸的浓度、温度。
新课程暑假作业本山西教育出版社系列答案
海淀黄冈名师暑假作业快乐假期吉林教育出版社系列答案
南方凤凰台假期之友暑假作业江苏凤凰教育出版社系列答案
暑假作业贵州科技出版社系列答案
Happy holiday快乐假期暑假电子科技大学出版社系列答案
暑假集训合肥工业大学出版社系列答案
暑假总复习暑假接力棒云南大学出版社系列答案
素质新目标暑假作业浙江人民出版社系列答案
暑假作业完美假期生活湖南教育出版社系列答案
暑假作业浙江科学技术出版社系列答案
【题目】在如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,其中P为电解质溶液。由此判断M、N、P所代表的物质可能是( )
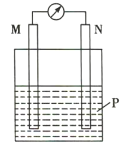
选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 锌 | 稀硫酸 |
C | 银 | 锌 | AgNO3溶液 |
D | 铜 | 铁 |
|
A.AB.BC.CD.D