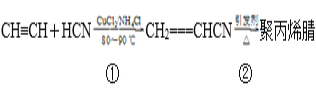
题目内容
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJ mol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJ mol-1。
请回答下列问题:
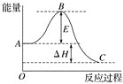
(1) 图中ΔH=___kJ mol-1。
(2) 如果反应速率υ(SO2)为0.05 molL-1min-1,则υ(O2)=___ molL-1min-1、υ(SO3)=____ molL-1min-1;
(3) 已知单质硫的燃烧热为296 kJ mol-1,计算由S(s)生成3 mol SO3(g)的ΔH=___kJ mol-1
【答案】-198 0.025 0.05 -1185
【解析】
(1) 图中为2mol SO2(g)参与反应时的焓变;
(2)化学反应速率之比等于化学计量数之比;
(3) 根据单质硫的燃烧热为296 kJ mol-1,及2SO2(g)+O2(g)![]() 2SO3(g)的焓变进行计算。
2SO3(g)的焓变进行计算。
(1) 图中为2mol SO2(g)参与反应时的焓变,则ΔH=﹣99kJ/mol×2=-198 kJmol-1;
(2)化学反应速率之比等于化学计量数之比,υ(SO2):υ(O2)=2:1,则υ(O2)=0.025molL-1min-1;υ(SO2):υ(SO3)=1:1,则υ(SO3)=0.05 mol L-1min-1;
(3) 已知单质硫的燃烧热为296 kJ mol-1,则S(s)+O2(g)=SO2(g)H=-296 kJ mol-1,2SO2(g)+O2(g)![]() 2SO3(g)H=-198 kJmol-1;生成3mol SO3(g)时,需要3molS(s)反应生成3mol SO2(g),则ΔH=-296kJ/mol×3-198kJ/mol×1.5=-1185 kJmol-1。
2SO3(g)H=-198 kJmol-1;生成3mol SO3(g)时,需要3molS(s)反应生成3mol SO2(g),则ΔH=-296kJ/mol×3-198kJ/mol×1.5=-1185 kJmol-1。

【题目】研究金属与硝酸的反应,实验如下。
实验 (20C) | 现象 |
Ⅰ | 无色气体(遇空气变红棕色),溶液变为蓝色 |
Ⅱ | 6mL无色气体(经检测为H2),溶液几乎无色 |
⑴Ⅰ中产生的无色气体是______。
⑵研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是______。
![]() 乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
![]() 补全Ⅱ中NO3-被还原为
补全Ⅱ中NO3-被还原为![]() 的过程:NO3- + ______e- + ______= NH4+ + ______H2O
的过程:NO3- + ______e- + ______= NH4+ + ______H2O
⑶研究影响产生H2的因素
实验 | 现象 |
Ⅲ | 3.4m L气体(经检测为H2),溶液略带黄色 |
Ⅳ | 2.6m L气体(经检测为H2),黄色溶液 |
Ⅴ | 无色气体(遇空气变红棕色),深棕色溶液 |
资料:Fe[(NO)]2+在溶液中呈棕色。 ④对比Ⅱ、Ⅲ、Ⅳ,温度不同时收集到氢气的体积不同,原因是______。 ⑤Ⅴ中无色气体是混合气体,则一定含有遇空气变红棕色的气体和______。 ⑷根据实验,金属与硝酸反应时,影响硝酸的还原产物不同的因素有______。