题目内容
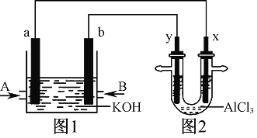
【题目】乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是( )

A. 该装置能量转化形式是电能转化为化学能
B. 负极反应式为:CH2=CH2-2e-+H2O=CH3CHO +2H+
C. 每有0.1 mol O2反应,则向负极迁移的H+的物质的量为0.4 mol
D. 电子移动方向:电极a→磷酸溶液→电极b
【答案】B
【解析】
A、该装置是原电池,化学能转化为电能,A错误;B、正极发生还原反应,电极方程式为O2+4H++4e-=2H2O,负极为CH2=CH2-2e-+H2O=CH3CHO+2H+,B正确;C、由电极方程式O2+4H++4e-=2H2O可知,每有0.1mol O2反应,则向正极迁移H+0.4mol,C错误;D、电子只能经过导线,不能经过溶液,D错误,答案选B。

【题目】共价键都有键能之说,键能是指拆开1 mol共价键所需要吸收的能量或形成1mol共价键所放出的能量。
(1)已知H—Cl键的键能为431.4 kJ/mol,下列关于键能的叙述正确的是______________。
A.每生成1 mol H—Cl键吸收431.4 kJ能量
B. 每生成1 mol H—Cl键放出431.4 kJ能量
C.每拆开1 mol H—Cl键放出431.4 kJ能量
D. 每拆开1 mol H—Cl键吸收431.4 kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是___________。
化学键 | H—H | H—F | H—Cl | H—Br |
键能/kJ/mol | 436 | 565 | 431 | 368 |
A. H2 B. HF C. HCl D. HBr
(3)能用键能大小解释的是____________。
A 常温常压下,溴呈液态,碘呈固态 B.氮气的化学性质比氧气稳定
C.稀有气体一般很难发生化学反应 D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,常温下,4mol HCl被氧化,放出115.6kJ的热量.
写出该反应的热化学方程式_____________________.
(5)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用如图简单表示(图中的△H表示生成1mol产物的数据)
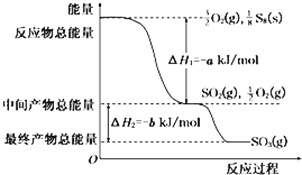
①写出表示S8燃烧热的热化学方程式:______________.
②写出SO3分解生成SO2和O2的热化学方程式:______________.