题目内容
12.“混盐”是指一种金属离子与多种酸根离子构成的盐,如CaOCl2就是一种混盐.“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐,如KAl(SO4)2就是一种复盐.下列各化合物中属于混盐的是( )| A. | Ca(NO3)Cl | B. | (NH4)2Fe(SO4)2 | C. | NaHCO3 | D. | K3[Fe(CN)6] |
分析 盐是由金属阳离子(铵根离子)和酸根阴离子组成的化合物,再结合题中信息和盐的定义进行分析判断.
解答 解:A、Ca(NO3)Cl,该物质是由一种金属阳离子和两种酸根离子构成的,因此属于混盐,故A正确;
B、(NH4)2Fe(SO4)2含有两种阳离子和一种酸根阴离子,不是混盐,是一种复盐,故B错误;
C、碳酸氢钠属于酸式盐,只有一种阴离子和阳离子构成,故C错误;
D、K3[Fe(CN)6]含有一种阳离子和一种酸根阴离子的盐,既不是复盐也不是混盐,故D错误,
故选A.
点评 本题是信息给予题,注意根据盐的概念和题目中信息分析解答,考查学生提练加工信息的能力.

练习册系列答案
相关题目
2.下列有关合金的说法中正确的是( )
| A. | 不锈钢是一种纯净物,它比纯铁的硬度大 | |
| B. | 铝合金是用量最大、用途最广的合金 | |
| C. | 青铜、硬铝和生铁都属于合金 | |
| D. | Na-K合金的熔点介于Na和K单质熔点之间 |
3.下列有关说法正确的是( )
| A. | 陶瓷的主要成分是碳酸钙 | |
| B. | 用铁容器存放浓盐酸 | |
| C. | 硅是制造半导体的常用材料 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
7.1mol•L-1 MgCl2溶液的含义是( )
| A. | 1L水中含有1 molMgCl2 | B. | 其中Cl-浓度为2 mol•L-1 | ||
| C. | 溶液中含有1 molMgCl2 | D. | 将95gMgCl2溶于1L水中所得的溶液 |
17.实验室蒸发NaCl溶液时,一般有以下操作过程:其正确的操作顺序为( )
①固定铁圈位置 ②加热蒸发,并不断搅拌③放置酒精灯④将蒸发皿放置在铁圈上⑤停止加热,利用余热蒸干.
①固定铁圈位置 ②加热蒸发,并不断搅拌③放置酒精灯④将蒸发皿放置在铁圈上⑤停止加热,利用余热蒸干.
| A. | ①②③④⑤ | B. | ②③④⑤① | C. | ③①④②⑤ | D. | ⑤④③②① |
4.下列物质长期放置在空气中能发生氧化还原反应的是( )
| A. | Na2O2 | B. | Na2SO4 | C. | Na2CO3 | D. | NaOH |
1.下列有关实验装置进行的相应实验,能达到实验目的是( )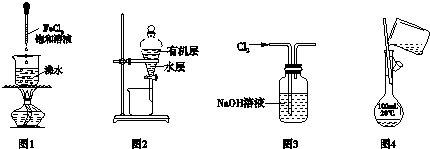

| A. | 用图1制备氢氧化铁胶体,当溶液至红褐色时继续煮沸 | |
| B. | 用图2所示装置分离CCl4萃取碘水后已分层的有机层和水层 | |
| C. | 用图3所示装置除去Cl2中含有的少量HCl气体 | |
| D. | 用图4所示装置配制实验所需100mL0.1mol/LNaCl溶液 |
11.往10mL 1mol/L AlCl3加入1mol/L NaOH溶液,得沉淀0.39g,则所加氢氧化钠溶液的体积可能为( )
| A. | 5 mL | B. | 25 mL | C. | 35 mL | D. | 45mL |
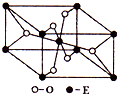 已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种已知轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种已知轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.