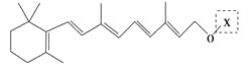
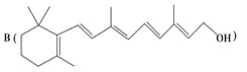
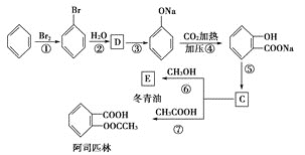
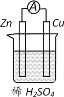
题目内容
【题目】研究表明,氮氧化物(NOx)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如下图所示。
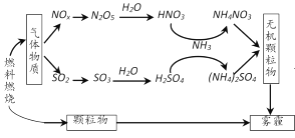
下列关于雾霾及其形成的叙述中,不正确的是
A.与燃料燃烧有关
B.涉及氧化还原反应
C.NH3是形成无机颗粒物的催化剂
D.雾霾中含有NH4NO3和(NH4)2SO4
【答案】C
【解析】
A.根据图示,燃料燃烧产生的颗粒物可形成雾霾,则雾霾及其形成与燃料燃烧有关,故A正确;
B.根据图示,硫元素和氮元素在转化过程中都发生化合价的变化,涉及氧化还原反应,故B正确;
C.根据图示,硝酸和硫酸都与NH3反应分别生成硝酸铵和硫酸铵,氨气参与了反应,属于反应物,故C错误;
D.根据图示,硝酸铵和硫酸铵形成无机颗粒物后形成雾霾,因此雾霾中含有NH4NO3和(NH4)2SO4,故D正确;
答案选C。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】下列实验中“实验内容”与验应“现象或结论”关系都正确的是
选项 | 实验内容 | 实验现象或结论 |
A | 分别往 4 mL 0.01 mol/L 、4 mL 0.02 mol/L KMnO4溶液加入2 mL 0.1 mol/L H2C2O4 溶液,记录褪色时间 | 浓度越大,反应速率越快越先褪色 |
B | 以石墨为电极,电解 KI溶液 (其中含有少量酚酞) | 阴极逸出气体且附近溶液呈现红色 |
C | 25℃时,向 pH=l 的盐酸和醋酸各 0.5L的溶液中各加入 1.4g 铁粉 | 醋酸中生成H2的速率快且最终气体 量多 |
D | 向 FeCl3+3KSCN | 血红色变浅,说明增加生成物浓度, 平衡逆向移动 |
A.AB.BC.CD.D
【题目】目前高铁酸钠(Na2FeO4)被广泛应用于水的处理,具有高效、无毒的优点。某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表(H+和OH-浓度小,未列出):
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
浓度/(mol·L-1) | a | 0.05 | 0.10 | 0.50 | 0.56 |
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2·7H2O,过程如下:
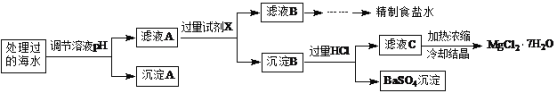
注:离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积的变化忽略不计。
(1)根据表中列出的离子浓度计算a=________。沉淀A是_______(填化学式)。
(2)在调节溶液pH时,理论上应调节的pH范围是_______;加入的过量试剂X为_______(填化学式)。
(3)加入过量HCl的作用为___________。
(4)用Fe作阳极、Cu作阴极,电解NaOH溶液可制得Na2FeO4,则电解过程中阳极的电极反应式为___________。