题目内容
17.现在实验室中需少量的一氯乙烷,下列制取方法中所得产物含量最高的是( )| A. | 乙烷与氯气光照反应 | B. | 乙烯与氯气加成反应 | ||
| C. | 乙烯与氢气、氯气混合气体反应 | D. | 乙烯与氯化氢加成反应 |
分析 制备一氯乙烷可用乙烯加成法、乙烷取代法等方法,最好的方法是乙烯加成的方法,没有副产品,得到的产物较为纯净.
解答 解:A.乙烷和氯气取代反应可生成一氯乙烷、二氯乙烷等多种取代物,产品不纯,且难以分离,故A错误;
B.乙烯和氯气加成反应生成二氯乙烷,不是一氯乙烷,故B错误;
C.乙烯与氢气发生加成反应生成乙烷,与氯气加成反应生成二氯乙烷,故与两者的混合气体反应得不到一氯乙烷,故C错误;
D.乙烯和HCl加成反应只生成一氯乙烷,得到的产物较为纯净,故D正确.故选D.
点评 本题考查一氯乙烷的制备方案的设计,题目难度不大,本题注意最佳方案的评价以及有机物的性质.

练习册系列答案
相关题目
7.下列有关物质性质的应用正确的是( )
| A. | 生石灰能与水反应,可用来干燥氯气 | |
| B. | 氯化铝是一种电解质,可用于电解法制铝 | |
| C. | 液氨汽化时要吸收大量的热,可用做制冷剂 | |
| D. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
5.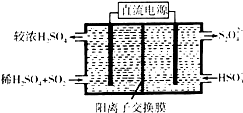 (1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
(1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
①由表判断,NaHSO3溶液显酸性,用化学平衡原理解释:溶液中存在:HSO3?SO32-+H+;HSO3-+H2O?H2SO3+OH-电离程度大于水解程度,故溶液显酸性.
②请写出Na2SO3溶液中离子浓度大小关系:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
(2)利用图示装置(电极均为惰性电极)吸收SO2,由阴极排出的溶液可吸收NO2.
①阴极的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O.
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成.写出该反应离子方程式:4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O.
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收的产物反应,得到一种复合肥.
①该复合肥料可能的化学式为(NH4)3PO4(或(NH4)2HPO4或NH4H2PO4)(只写一种).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”“碱”或“中”).已知常温下NH3•H2O的Kb=1.8×10-5mol•L-1,H2SO3的Ka1=1.3×10-2mol•L-1Ka2=6.3×10-8mol•L-1.
③当氨水吸收SO2至恰好完全反应形成正盐时,反应过程中H2O的电离平衡移动方向为向右(填“向左”“向右”或“不”).
 (1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
(1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②请写出Na2SO3溶液中离子浓度大小关系:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
(2)利用图示装置(电极均为惰性电极)吸收SO2,由阴极排出的溶液可吸收NO2.
①阴极的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O.
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成.写出该反应离子方程式:4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O.
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收的产物反应,得到一种复合肥.
①该复合肥料可能的化学式为(NH4)3PO4(或(NH4)2HPO4或NH4H2PO4)(只写一种).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”“碱”或“中”).已知常温下NH3•H2O的Kb=1.8×10-5mol•L-1,H2SO3的Ka1=1.3×10-2mol•L-1Ka2=6.3×10-8mol•L-1.
③当氨水吸收SO2至恰好完全反应形成正盐时,反应过程中H2O的电离平衡移动方向为向右(填“向左”“向右”或“不”).
12.有BaCl2和NaCl的混合溶液aL,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀.反应中消耗xmol H2SO4、ymol AgNO3.据此得知原混合溶液中的c(Na+)为( )
| A. | $\frac{y-2x}{a}$ mol/L | B. | $\frac{y-x}{a}$ mol/L | C. | $\frac{2y-2x}{a}$ mol/L | D. | $\frac{2y-4x}{a}$mol/L |
2.某有机物的结构为 ,下列关于该有机物性质的说法错误的是( )
,下列关于该有机物性质的说法错误的是( )
 ,下列关于该有机物性质的说法错误的是( )
,下列关于该有机物性质的说法错误的是( )| A. | 能跟NaOH溶液反应 | |
| B. | 1mol该有机物与足量的钠反应产生2mol H2 | |
| C. | 能发生酯化反应 | |
| D. | 能使酸性KMnO4溶液褪色 |
6.不能作为判断硫、氯两种元素非金属性强弱的依据是( )
| A. | 单质氧化性的强弱 | |
| B. | 单质沸点的高低 | |
| C. | 单质与氢气化合的难易 | |
| D. | 最高价氧化物对应的水化物酸性的强弱 |
6.己知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵中,形成无色的溶液.其化学方程 式是PbSO4+2CH3COONH4→(NH4)2SO4+(CH3COO)2Pb.当在醋酸铅溶液中通入硫化氢时,有黑色沉淀硫化铅生成.表示这个反应的离子方程式正确的是( )
| A. | (CH3COO)2Pb+H2S→PbS↓+2CH3COOH | |
| B. | Pb2++2CH3COO-+H2S→PbS↓+2CH3COOH | |
| C. | Pb2++H2S→PbS↓+2H+ | |
| D. | Pb2++2CH3COO-+2H++S2-→PbS↓+2CH3COOH |
 研究金属铁及其化合物的性质有重要意义.
研究金属铁及其化合物的性质有重要意义.