题目内容
【题目】“雾霾”成为人们越来越关心的环境问题.雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质.请回答下列问题:
(1)汽车尾气是雾霾形成的原因之一.尾气治理可用汽油中挥发出来的烃类物质 (CxHy)催化还原尾气中的NO气体,该过程的化学方程式为 .
(2)冬季燃煤供暖产生的废气也是雾霾的主要来源之一.经研究发现将煤炭在 ![]() 的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为: . 2NO(g)+2CO(g)N2(g)+2CO2 (g)△H
的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为: . 2NO(g)+2CO(g)N2(g)+2CO2 (g)△H
已知:
①N2(g)+O2(g)2NO(g)△H1=+180.5kJmol﹣1
②2CO(g)2C(s)+O2(g)△H2=+221kJmol﹣1
③C(s)+O2(g)CO2(g)△H3=﹣393.5kJmol﹣1
则△H=
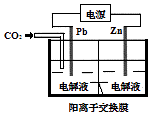
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨. 
①a表示离子交换膜(填“阴”或“阳”).A﹣E分别代表生产中的原料或产品.其中C为硫酸,则A表示 . E表示 .
②阳极的电极反应式为 .
(4)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的 反应为:2SO2(g)+O2(g)2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2):n(O2)=2:1],测得容器内总压强与反应时间如图二所示.
①图中A点时,SO2的转化率为 .
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,刻C点的正反应
速率vc(正)与A点的逆反应速率vc (逆)的大小关系为vc(正)vc (逆) (填“>”、“<”或“=”)
③图中B点的压强平衡常数kp=(用平衡分压代替平衡浓度计算.分压=总压×物质的量分数).
【答案】
(1)4CxHy+(8x+2y)NO=4XCO2+(4x+y)N2+2yH2O
(2)2NO(g)+2CO(g)?N2(g)+2CO2(g);﹣746.5kJ?mol﹣1
(3)阳;NaOH溶液;氢气;SO32﹣﹣2e﹣+H2O=2H++SO42﹣
(4)45%;>
【解析】解:(1)(CxHy)催化还原尾气中的NO气体生成氮气、二氧化碳和水,结合原子守恒配平书写化学方程式为:4CxHy+(8x+2y)NO=4XCO2+(4x+y)N2+2yH2O,所以答案是:4CxHy+(8x+2y)NO=4XCO2+(4x+y)N2+2yH2O;(2)②×2+③×2﹣①得到2NO(g)+2CO(g)N2(g)+2CO2(g),反应的焓变=2(+110.5kJmol﹣1)+2(﹣393.5kJmol﹣1)﹣(180.5kJmol﹣1)=﹣746.5kJmol﹣1 ,
所以答案是:﹣746.5kJmol﹣1;(3)①从C为硫酸可知,硫酸根来源于亚硫酸根放电.故b为阴离子交换膜,a为阳离子交换膜,在阴极区应为水放电生成氢气和氢氧根离子,故A为氢氧化钠,E为氢气,
所以答案是:阳;NaOH溶液;氢气;②阳极应为亚硫酸根放电生成硫酸根,反应的离子方程式为SO32﹣﹣2e﹣+H2O=2H++SO42﹣ ,
所以答案是:SO32﹣﹣2e﹣+H2O=2H++SO42﹣;(4)①依据化学三行列式计算,设氧气消耗物质的量为x,
2SO2(g)+ | O2(g) | 2SO3 | |
起始量(mol) | 2a | a | 0 |
变化量(mol) | 2x | x | 2x |
平衡量(mol) | 2a-2x | a-x | 2x |
图中A点时,气体物质的量0.085,则 ![]() =
= ![]() ,x=0.45a
,x=0.45a
SO2的转化率= ![]() ×100%=45%,
×100%=45%,
所以答案是:45%;②图象分析可知,先拐先平温度高则T1<T2 , C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系为vC(正)>vA(逆)
所以答案是:>;③图中B点,依据化学三行列式计算,设氧气消耗物质的量为y,
2SO2(g)+ | O2(g) | 2SO3 | |
起始量(mol) | 2a | a | 0 |
变化量(mol) | 2y | y | 2y |
平衡量(mol) | 2a-2y | a-y | 2y |
B点气体物质的量为 0.007,则 ![]() =
= ![]() ,y=0.9a,
,y=0.9a,
平衡常数K=(  =24300(MPa)﹣1 ,
=24300(MPa)﹣1 ,
所以答案是:24300(MPa)﹣1 .
【考点精析】本题主要考查了反应热和焓变和化学平衡的计算的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=;若其他条件不变,容器体积缩小为1L,则K值 . (增大、减小或不变);若K300°C>K350°C , 则该反应是热反应.
(2)用O2表示从0~2s内该反应的平均速率v=;
(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.