题目内容
【题目】三氯化硼是一种重要的化工原料,某同学设计的三氯化硼制备装置如图. 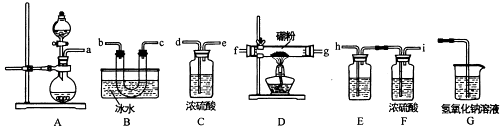
【查阅资料】
①BCl3:的熔点为﹣107.3℃,沸点为12.5℃
②2B+6HCl ![]() 2BCl3+3h2
2BCl3+3h2
③硼与侣的性质相似,也能与氢氧化钠溶液反应
请回答下列题:
(1)A装置可用高高锰酸钾固体与浓盐酸反应制氯气,反应的化学方程式为 .
(2)为了完成三氯化硼的制备,装置从左到右的接口连接顺序为 .
(3)装里E中的试剂为 . 如果拆去E装置,可能的后果是 .
(4)D装置中发生反应前先通入一段时间的氯气,其目的是 . 该装置中发生反应的化学方程式为 .
(5)三氯化硼与水能剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式 .
(6)请设计一个简易实验,验证制得的产品中是否含有硼粉 .
【答案】
(1)2KMnO4+10HCl=2MnCl2+2KCl+8H2O+5Cl2↑
(2)a﹣hi﹣fg(或gf)﹣bc(或cb)﹣de﹣j
(3)饱和食盐水;粉与氯化氢气体反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸
(4)排尽装置中的空气,避免氧气与硼粉发生反应生成B2O3;2B+3Cl2 ![]() 2BCl3
2BCl3
(5)BCl3+3H2O=H3BO3+3HCl↑
(6)取少量样品于试管中,滴加浓NaOH溶液,若有气泡产生,则样品中含有硼粉,若无气泡产生,则样品中无硼粉
【解析】解:(1)A装置可用高高锰酸钾固体与浓盐酸反应制氯气,反应的化学方程式为:2KMnO4+10HCl=2MnCl2+2KCl+8H2O+5Cl2↑;所以答案是:2KMnO4+10HCl=2MnCl2+2KCl+8H2O+5Cl2↑;(2)A中生成Cl2 , 但生成的Cl2中含有HCl、H2O,为了得到较纯净的Cl2 , 饱和食盐水能吸收HCl,浓硫酸能干燥气体,故a连接hi,在D中制得BCl3 , 故再连接fg(或gf),然后用B得到BCl3固体,连接bc(或cb),为防止G中的水蒸气进入B装置使生成的BCl3水解,需在B和G中间添加装置C装浓硫酸进行干燥,G吸收未反应的Cl2 , 则再连接dej;
所以答案是:a﹣hi﹣fg(或gf)﹣bc(或cb)﹣de﹣j;(3)E中试剂为饱和食盐水,为吸收氯气中的HCl气体,若无此装置,氯化氢气体进入D装置,硼粉与氯化氢气体反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸;
所以答案是:饱和食盐水;硼粉与氯化氢气体反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸;(4)硼粉易被空气中的氧气氧化,故D装置中发生反应前先通入一段时间的氯气,其目的是排尽装置中的空气,避免氧气与硼粉发生反应生成B2O3 , D装置中发生反应的化学方程式为:2B+3Cl2 ![]() 2BCl3;
2BCl3;
所以答案是:排尽装置中的空气,避免氧气与硼粉发生反应生成B2O3;2B+3Cl2 ![]() 2BCl3;(5)因硼与铝的性质相似,硼酸的化学式为H3BO3 , 类似铝酸(H3AlO3).因三氯化硼遇水能反应,反应的化学方程式为:BCl3+3H2O=H3BO3+3HCl↑;
2BCl3;(5)因硼与铝的性质相似,硼酸的化学式为H3BO3 , 类似铝酸(H3AlO3).因三氯化硼遇水能反应,反应的化学方程式为:BCl3+3H2O=H3BO3+3HCl↑;
所以答案是:BCl3+3H2O=H3BO3+3HCl↑;(6)由于B的性质与Al相似,既能与强酸反应,也能与强碱反应放出氢气,所以取少量样品于试管中,滴加浓NaOH溶液,若有气泡产生,则样品中含有硼粉,若无气泡产生,则样品中无硼粉;
所以答案是:取少量样品于试管中,滴加浓NaOH溶液,若有气泡产生,则样品中含有硼粉,若无气泡产生,则样品中无硼粉.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案