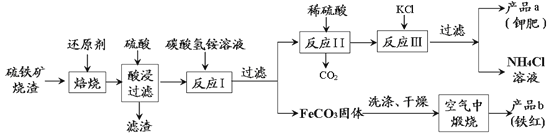
题目内容
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料,而氢气、二甲醚等都是很有发展前景的新能源。
(1)在25℃、101kPa时,1gCH4完全燃烧生成液态水时放出的热量是55.64 kJ,则表示甲烷燃烧热的热化学方程式是___________________________________________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2 220.0 kJ· mol-1,已知CO气体燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-565.14 kJ·mol-1,试计算相同物质的量的C3H8和CO燃烧产生的热量的比值________(保留小数点后一位)。
(3)氢气既能与氮气发生反应又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ· mol-1
3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92.4 kJ· mol-1
2NH3(g) ΔH=-92.4 kJ· mol-1
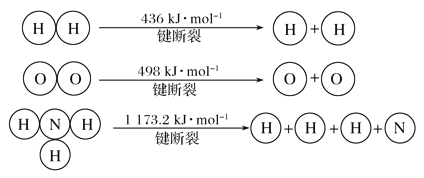
计算断裂1 mol N≡N键需要消耗能量________kJ。
(4)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:①CO(g)+2H2(g)===CH3OH(g) ΔH1=-90.1 kJ· mol-1
②CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH2=-49.0 kJ· mol-1
水煤气变换反应:③CO(g)+H2O(g)===CO2(g)+H2(g) ΔH3=-41.1 kJ· mol
二甲醚合成反应:④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ· mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为_______________________。根据化学反应原理,分析增大压强对直接制备二甲醚反应的影响:_________________________________________________。
【答案】 CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.24 kJ· mol-1 7.9 946 2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ· mol-1 该反应分子数减少,压强升高使平衡右移,CO和H2的转化率增大,CH3OCH3产率增加;压强升高使CO和H2浓度增加,反应速率增大
【解析】试题解析:(1)燃烧热是指1 mol可燃物完全燃烧生成稳定化合物时所放出的热量;
(2)根据热化学方程式分别计算1molC3H8和1molCO燃烧放出的热量,在金属比值;(3)根据 焓变=反应物的总键能-生成物的总键能计算;(4)根据盖斯定律计算由H2和CO直接制备二甲醚的热化学方程式;加压有利于平衡向气体系数和小的方向移动。
解析:(1) 1gCH4完全燃烧生成液态水时放出的热量是55.64 kJ,则1mol甲烷燃烧放热55.64 kJ×16=890.24 kJ,甲烷燃烧热的热化学方程式是CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.24 kJ· mol-1;(2) 2 220.0 kJ·mol-1÷![]() kJ·mol-1≈7.9;(3)3H2(g)+N2(g)
kJ·mol-1≈7.9;(3)3H2(g)+N2(g) ![]() 2NH3(g)中,断裂1molN≡N键和3molH-H键,形成6molN-H键,则E(N≡N)+3E(H-H)-6E(N-H)=-92.4kJ·mol-1,则E(N≡N)=1173.2kJ·mol-1×2-436kJ·mol-1×3-92.4kJ·mol-1=946kJ·mol-1;(4)根据盖斯定律,①×2+④得:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)
2NH3(g)中,断裂1molN≡N键和3molH-H键,形成6molN-H键,则E(N≡N)+3E(H-H)-6E(N-H)=-92.4kJ·mol-1,则E(N≡N)=1173.2kJ·mol-1×2-436kJ·mol-1×3-92.4kJ·mol-1=946kJ·mol-1;(4)根据盖斯定律,①×2+④得:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)
ΔH=-90.1kJ·mol-1×2-24.5kJ·mol-1=-204.7kJ·mol-1。这是一个气体分子数减小的反应,增大压强,平衡正向移动,有利于提高反应速率和二甲醚的生成。