题目内容
【题目】硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如下图所示:
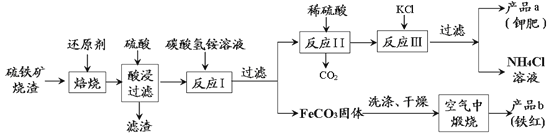
(1)硫铁矿烧渣焙烧时所添加的还原剂最有可能的是______。
A.铝 B.锌 C.碳
(2)酸浸、过滤后滤液中的主要成分是________。滤渣是__________。
(3)反应Ⅰ的溶液为防止被氧化,需加___________,其离子方程式为__________________。
(4)反应Ⅰ的反应温度一般需控制在15℃以下,其目的是____________________。
(5)空气中煅烧FeCO3生成产品b的化学反应方程式为_____________________。
(6)检验产品a中是否含有氯化物杂质的实验操作是:取少量产品a于试管中配成溶液,___________。
【答案】C FeSO4(或FeSO4和H2SO4) SiO2 稀硫酸还要加入少量铁粉 4Fe2++O2+4H+=4Fe3++2H2O 防止NH4HCO3分解(或减少Fe2+的水解) 4FeCO3+O2 ![]() 2Fe2O3+4CO2↑ 滴加过量Ba(NO3)2溶液,过滤后向滤液中滴加AgNO3溶液
2Fe2O3+4CO2↑ 滴加过量Ba(NO3)2溶液,过滤后向滤液中滴加AgNO3溶液
【解析】
硫铁矿烧渣在灼烧时加入碳,发生氧化还原反应生成铁,加入硫酸后Fe与硫酸反应生成硫酸亚铁,过滤后得到的滤渣为二氧化硅,滤液中加入碳酸氢铵溶液,可生成碳酸亚铁固体,经洗涤、干燥,在空气中灼烧时发生分解,且与空气中的氧气发生氧化还原反应,可生成铁红,反应Ⅰ过滤后所得溶液为硫酸铵和碳酸氢铵的混合物,加入硫酸得到硫酸铵,加入氯化钾可得到氯化铵和硫酸钾,以此解答该题。
(1)硫铁矿烧渣焙烧时所添加的还原剂最有可能的是碳,若加入金属铝或锌,可引入新杂质,而加入碳被氧化生成CO2气体,从固体产物中逸出,因此不会引入新杂质,故合理选项是C;
(2)焙烧后的固体为Fe和SiO2的混合物,加入H2SO4,Fe与H2SO4反应生成FeSO4,如H2SO4过量,则滤液中还含有H2SO4,而SiO2不溶于稀H2SO4,所以过滤后的滤渣为SiO2;
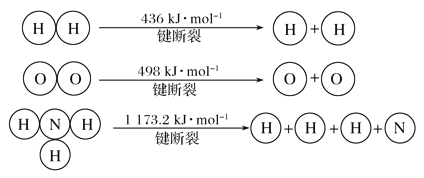
(3)为防止FeSO4溶液中Fe2+的水解及氧化,可加入适当稀硫酸抑制Fe2+水解,加入少量铁粉防止Fe2+氧化,其中Fe2+发生氧化反应时的离子反应方程式为4Fe2++O2+4H+=4Fe3++2H2O;
(4)NH4HCO3不稳定,受热分解为NH3、H2O、CO2,所以反应I的反应温度一般需在较低的稳定下进行,一般控制在35℃以下,其目的是防止碳酸氢铵受热分解;
(5)FeCO3与O2在高温下反应生成了Fe2O3和CO2,反应方程式为4FeCO3+O2 ![]() 2Fe2O3+4CO2↑;
2Fe2O3+4CO2↑;
(6)产品a主要为K2SO4,为检验是否含有氯化物杂质,应加入AgNO3溶液,由于AgNO3溶液会与K2SO4反应产生Ag2SO4白色沉淀,为排除干扰,在加入AgNO3溶液之前应加入过量的Ba(NO3)2溶液,使SO42-形成BaSO4沉淀,以除去SO42-的干扰,过滤后再加入硝酸银溶液。

【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产高纯度LiOH的工艺流程如图:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)
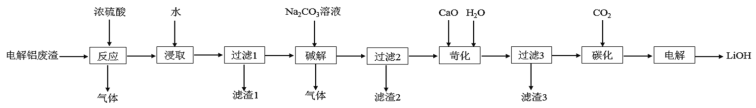
(1)含锂电解铝废渣与浓硫酸在200~400℃条件下反应2h。“滤渣1”主要成分是___(填化学式)。
(2)“过滤2”需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是___。
(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40°C下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为___;若碱解前滤液中c(Li+)=4molL-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则“滤液2”中c(CO32-)=___molL-1。[Ksp(Li2CO3)=1.6×10-3]
(4)“苛化”过程,若氧化钙过量,则可能会造成___。
(5)整个工艺流程中可以循环利用的物质有___。
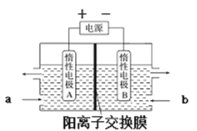
(6)“电解”原理如图所示。“碳化”后的电解液应从(填“a”或“b”)___口注入。阴极的电极反应式为___。
(7)高纯度LiOH可转化为电池级Li2CO3。将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式为___。