题目内容
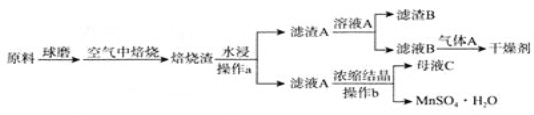
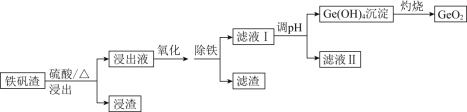
【题目】二氧化锗(GeO2)可用于制备半导体材料,某实验小组以铁矾渣(主要成分为FeO、CaO、GeO和SiO2等)为原料制取二氧化锗的工艺流程如下所示。
已知:25℃时,部分金属阳离子转化为氢氧化物沉淀时的pH如下表所示。
离子 | Fe3+ | Mn2+ | Ge4+ |
开始沉淀时的pH | 2.3 | 8.3 | 8.2 |
沉淀完全时的pH | 4.1 | 9.8 | 11.2 |
请回答下列问题:
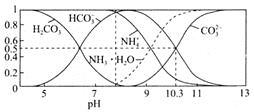
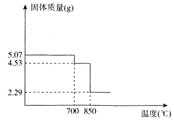
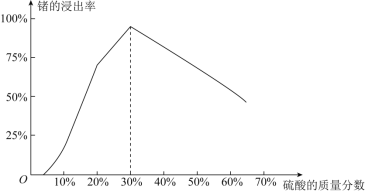
(1)由下图可知,“浸出”时,所用硫酸的最佳质量分数为________,浸渣的主要成分为________________(填化学式)。
(2)“氧化”时,可选用的试剂为________(填字母)。
A.KMnO4 B.NaOH C.H2O2 D.I2
(3)“氧化”时,若以适量稀硝酸作氧化剂,则Ge2+被氧化的离子方程式为________________。“氧化”后,选用K3[Fe(CN)6]溶液证明Fe2+已全部被氧化的实验现象为________________________________________________。
(4)“除铁”时,可选用Na2CO3为除铁剂,其原理为____________________________。
(5)已知Ge(OH)4,具有两性,在得到Ge(OH)4的过程中,若溶液的pH大于12,会导致Ge(OH)4溶解,写出该反应的离子方程式:________________________________。
(6)利用惰性电极电解酸性GeSO4溶液也可制得GeO2,则阳极的电极反应式为___________________。
【答案】30% SiO2、CaSO4 C 3Ge2++8H++2NO3-=3Ge4++2NO↑+4H2O 加入K3[Fe(CN)6]溶液后,无蓝色沉淀产生 Na2CO3可以消耗溶液中的H+,使溶液的pH升高,Fe3+转化为Fe(OH)3沉淀 Ge(OH)4+2OH-=GeO32-+3H2O Ge2++2H2O-2e-=GeO2+4H+
【解析】
(1)由图判断;浸渣为不溶物和生成的微溶物;
(2)“氧化”时,为了不引入新的杂质,可选用的试剂为H2O2;
(3)根据流程Ge2+被氧化为Ge4+;K3[Fe(CN)6]与Fe2+反应生成蓝色沉淀;
(4)“除铁”时,用Na2CO3调节溶液的pH达到除铁目的;
(5)Ge(OH)4具有两性,碱性条件下导致Ge(OH)4溶解生成GeO32-;
(6)利用惰性电极电解酸性GeSO4溶液也可制得GeO2,则Ge2+失电子化合价升高,生成GeO2。
(1)由图可知,“浸出”时,所用硫酸的最佳时质量分数为30%,浸渣的主要成分为SiO2、CaSO4;
(2)“氧化”时,为了不引入新的杂质,可选用的试剂为H2O2,答案为C;
(3)根据流程Ge2+被氧化为Ge4+,离子方程式为3Ge2++8H++2NO3-=3Ge4++2NO↑+4H2O,K3[Fe(CN)6]与Fe2+反应生成蓝色沉淀,则“氧化”后,加入K3[Fe(CN)6]溶液无蓝色沉淀产生,证明Fe2+已全部被氧化;
(4)“除铁”时,用Na2CO3调节溶液的pH达到除铁目的,其原理为Na2CO3可以消耗溶液中的H+,使溶液的pH升高,Fe3+转化为Fe(OH)3沉淀;
(5)Ge(OH)4具有两性,溶液的pH大于12,显碱性,导致Ge(OH)4溶解生成GeO32-,则离子方程式为Ge(OH)4+2OH-=GeO32-+3H2O;
(6)利用惰性电极电解酸性GeSO4溶液也可制得GeO2,则Ge2+失电子化合价升高,生成GeO2,则阳极的电极反应式为Ge2++2H2O-2e-=GeO2+4H+。

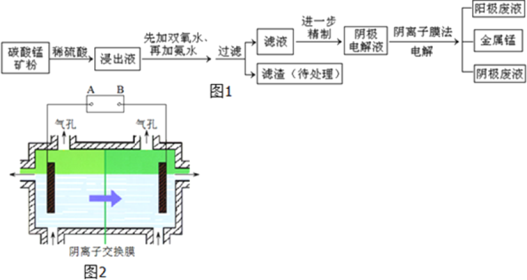
【题目】某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如图1:阴离子膜法电解装置如图2所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式______.
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如表:
离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
加氨水调节溶液的pH等于6,则滤渣的成分是______,滤液中含有的阳离子有H+和______.
(3)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因______.
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的______极.实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为______.
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式______.