题目内容
【题目】(1)①某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应:
)在刚性容器内发生反应:![]() (g)+I2(g)===
(g)+I2(g)===![]() (g)+2HI(g),起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数Kp=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
(g)+2HI(g),起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数Kp=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
②环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1
(2) 298 K时,将20 mL 3x mol·L-1Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO33- (aq)+I2(aq)+2OH-(aq)![]() AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。

下列可判断反应达到平衡状态的是________(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.  不再变化
不再变化
d.c(I-)=y mol·L-1
(3)已知反应2HI(g) ![]() H2(g)+I2(g),ΔH>0,由实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。
H2(g)+I2(g),ΔH>0,由实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。

【答案】40% 3.56×104 BD CD a、c A、E
【解析】
(1)运用“三段式”法计算平衡时各反应物的物质的量,根据气体物质的量之比等于压强之比,计算转化率及平衡常数;(2)根据平衡状态的本质和特征分析解答;(3)根据平衡状态的建立及外界条件对平衡移动的影响分析解答。
(1)①设碘和环戊烯(![]() )的初始物质的量都为nmol,转化的物质的量为xmol,
)的初始物质的量都为nmol,转化的物质的量为xmol,
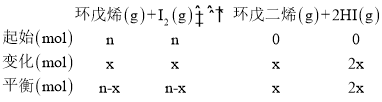
刚性容器内气体的压强与物质的量成正比,则:![]() =1+20%,解得:x=0.4n,平衡时环戊烯的转化率为:
=1+20%,解得:x=0.4n,平衡时环戊烯的转化率为:![]() ;
;
平衡时混合气体的压强为:105Pa×(1+20%)=1.2×105Pa,混合气体总物质的量为:(n-0.4n+n-0.4n+0.4n+0.4n×2)mol=2.4nmol,平衡时各组分所占压强分别为p(![]() )=p(I2)=
)=p(I2)=![]() ,p(
,p(![]() )=
)=![]() ,
,
p(HI)=![]() ,该反应的平衡常数Kp=
,该反应的平衡常数Kp= ;
;
A.通入惰性气体,各组分浓度不变,平衡不移动,则环戊烯的转化率不变,故A错误;
B.该反应为吸热反应,提高温度平衡向着正向移动,环戊烯的转化率增大,故B正确;
C.增加环戊烯浓度,环戊烯的转化率减小,故C错误;
D.增加碘浓度,反应物浓度增大,平衡向着正向移动,环戊烯的转化率增大,故D正确;
故答案为:40%;3.56×104;BD;
②A. 温度越高反应速率越快,根据图示可知,在温度T2(虚线)的反应速率较大,则T1<T2,故A错误;
B. 温度:a<c,浓度a>c,无法比较a、c点反应速率,故B错误;
C. a到b的过程为正反应速率逐渐减小,且b点v(正)>v(逆),则a点的正反应速率大于b点的逆反应速率,故C正确;
D. b点时环戊二烯的浓度变化为:1.5mol/L-0.6mol/L=0.9mol/L,环戊二烯的二聚体的浓度为环戊二烯浓度变化的1/2,则b点时二聚体的浓度为0.9mol/L×1/2=0.45molL-1,故D正确;故答案为:CD;
(2)a. 溶液pH不变时,则c(OH)也保持不变,反应达到平衡状态,故a正确;
b. 同一个化学反应,速率之比等于化学计量数之比,无论是否达到平衡,都存在v(I-)=2v(AsO33-),故b错误;
c. 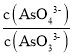 不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;
不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;
d. 由图可知,当c(AsO43)=ymolL1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I)=2ymolL1,故d错误;故答案为:ac;
(3)对于2HI(g)H2(g)+I2(g),反应建立平衡时:升高温度,正、逆反应速率均加快,因此排除C点,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,因此平衡正向移动,再次平衡时HI的物质的量分数减小,因此排除B点,故选A点;对于H2(g)+I2(g)2HI(g),反应建立平衡时:升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动,因此平衡逆向移动,再次平衡时H2的物质的量分数增大,故选E点;因此反应重新达到平衡,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E,故答案为:A、E。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】为实现下列实验目的,下表提供的主要仪器以及所用试剂均合理的是( )
选项 | 实验目的 | 主要仪器 | 试剂 |
A | 配制480mL | 胶头滴管、烧杯、玻璃棒、托盘天平、480mL容量瓶 | NaOH固体、蒸馏水 |
B | 分离 | 分液漏斗、烧杯 | 乙醇 |
C | 鉴别 | 试管、胶头滴管 | 澄清石灰水 |
D | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
A.AB.BC.CD.D