题目内容
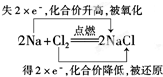
4.分析下列反应的化学方程式,是氧化还原反应的线桥法标出电子转移的方向和数目,指出被氧化和被还原的元素.(1)2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl
(2)NaOH+HCl═NaCl+H2O不是氧化还原反应.
分析 有电子转移的化学反应是氧化还原反应,
(1)中Na元素化合价由0价变为+1价、Cl元素化合价由0价变为-1价,所以属于氧化还原反应,转移电子数为2;
(2)中各元素化合价不变,不属于氧化还原反应.
解答 解:有电子转移的化学反应是氧化还原反应,其特征是有元素化合价升降,
(1)2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl中Na元素化合价由0价变为+1价、Cl元素化合价由0价变为-1价,所以属于氧化还原反应,转移电子数为2,转移电子方向和数目为 ,
,
故答案为: ;
;
(2)NaOH+HCl═NaCl+H2O中各元素化合价不变,不属于氧化还原反应,属于复分解反应,
故答案为:不是氧化还原反应.
点评 本题考查氧化还原反应判断、电子转移方向和数目的书写,侧重考查基本概念,熟悉常见元素化合价变化,知道氧化还原反应本质和特征的区别.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
14.下列各组溶液,不用其他试剂,就能将组内物质鉴别出来的是( )
| A. | CuSO4 NaOH BaCl2 HCl | B. | NaCl HCl H2SO4 AgNO3 | ||
| C. | KCl HCl NaOH BaCl2 | D. | NaOH KOH MgCl2 H2SO4 |
15.已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,将1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量(忽略能量损失)( )
| A. | 一定大于92.4 kJ | B. | 一定小于92.4 kJ | C. | 一定等于92.4 kJ | D. | 无法确定 |
9.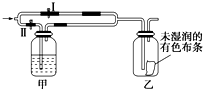 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
①浓硫酸②饱和氯化钠溶液 ③Na2SO3溶液 ④饱和FeBr2溶液.
 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )①浓硫酸②饱和氯化钠溶液 ③Na2SO3溶液 ④饱和FeBr2溶液.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
16.体积均为100mL,浓度均为1mol.L-1的盐酸和硫酸溶液,分别加入质量相等的镁块充分反应,所生成的气体在相同条件下体积比为2:3,则镁块的质量为( )
| A. | 1.8 g | B. | 2.4g | C. | 3.6g | D. | 4.8g |
13.下列比较正确的是( )
| A. | 稳定性:CH4>NH3>H2O>HF | B. | 熔沸点:CaO>BaO>NaCl>KCl | ||
| C. | 熔沸点:Na>Mg>Al | D. | 熔沸点:HF<HCl<HBr<HI |
14.关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②可以贮存溶液;③使用之前要检查是否漏水;④能用来加热.这些叙述中正确的是 ( )
| A. | ①②③④ | B. | ②③ | C. | ①③ | D. | ②③④ |