题目内容
SF6是一种优良的绝缘气体,分子结构中存在S-F键。已知S8(s)的分子结构模型(如图),断裂1molS—S、1molF—F 、1molS—F键需吸收的能量分别为280kJ 、160kJ、330kJ.则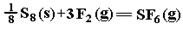 :的反应热ΔH为 ( )
:的反应热ΔH为 ( )
| A.-1780kJ·mol-1 | B.-1220kJ·mol-1 | C.-450kJ·mol-1 | D.+430kJ·mol-1 |
B
解析试题分析:由图示可以看出1molS8分子含有8molS—S键,反应热ΔH为280kJ+160kJ×3+(-330kJ×6)=-1220kJ·mol-1
考点:考查基本理论,通过化学键的变化计算ΔH

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)=2H2O(l) △H1=-akJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) △H2=-bkJ·mol-1
③C(s)+1/2O2(g)=CO(g) △H3=-ckJ·mol-1
④C(s)+O2(g)=CO2(g) △H4=-dkJ·mol-1
下列说法错误的是
| A.氢气的燃烧热为△H=-akJ·mol-1 | B.c<d |
| C.一氧化碳的燃烧热为△H=-(d-c)kJ·mol-1 | D.0.5a>b |
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是
| A.Q1< Q2 |
| B.石墨不如金刚石稳定 |
| C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低 |
| D.质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多 |
已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol 。下列说法或表达正确的是: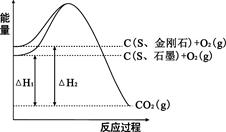
| A.金刚石比石墨稳定 |
| B.C(s、石墨)=C(s、金刚石)△H =+1.5kJ/mol |
| C.△H1<△H2 |
| D.如果使用催化剂,△H1和△H2都变小 |
“低碳经济,节能减排”是21世纪世界经济发展的新思路。”下列与之相悖的是( )
| A.开发水能、风能、太阳能、地热能、核能等新能源,减少使用煤、石油等化石燃料 |
| B.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 |
| C.大力开采煤、石油和天然气,以满足经济发展的需要 |
| D.大力发展新能源汽车,如混合动力汽车、电动汽车等,以减少碳、氮氧化物的排放 |
已知298 K、101 kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9 kJ·mol-1
②4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.1 kJ·mol-1
由此得出的正确结论是( )
| A.等质量的O2比O3能量低,由O2变为O3为放热反应 |
| B.O3比O2稳定,由O2变为O3为吸热反应 |
| C.O2比O3稳定,由O2变为O3为放热反应 |
| D.等质量的O2比O3能量低,由O2变为O3为吸热反应 |
下列有关化学反应能量变化的叙述一定正确的是
| A.生成物总能量大于反应物总能量,该反应为放热反应 |
| B.一个化学反应需要加热才能进行,该反应为吸热反应 |
| C.应用盖斯定律,可计算某些难以直接测量的化学反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的?H不同 |
已知: (1)NH3(g)+HCl(g)=NH4Cl(s); △H1=-76kJ·mol-1
(2)NH3(g)+H2O(l)=NH3·H2O(aq); △H2=-35.1kJ·mol-1
(3)HCl(g)+HCl (aq); △H3=-72.3kJ·mol-1
(4)HCl (aq) NH3·H2O(aq) =NH4Cl(aq)+H2O(l); △H4=-52.3kJ·mol-1
(5)NH4Cl(s)=NH2Cl(aq); △H5=?
根据盖斯定律,则(5)方程式中的反应热△H5为
| A.-335.7 kJ·mol-1 | B.-16.3 kJ·mol-1 |
| C.+16.3 kJ·mol-1 | D.-83.7 kJ·mol-1 |
下列说法不正确的是
A.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡正向移动 NH3·H2O+H+达到平衡后,升高温度平衡正向移动 |
| B.在海轮的外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C.明矾水解生成Al(OH)3胶体,可用作净水剂 |
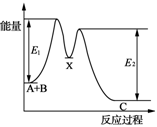
| D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0 |