题目内容
根据碘与氢气反应的热化学方程式
(i)I2(g)+ H2(g)  2HI(g)+ 9.48 kJ (ii) I2(s)+ H2(g)
2HI(g)+ 9.48 kJ (ii) I2(s)+ H2(g) 2HI(g) - 26.48 kJ
2HI(g) - 26.48 kJ
下列判断正确的是
| A.1mol I2(s)中通入2gH2(g),反应吸热26.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
| D.反应(i)放出的热量多,所以产物的能量低,比反应(ii)的产物更稳定 |
C
解析试题分析:A、因为是可逆反应,所以不能进行完全,所以反应吸热小于26.48 kJ,A错误;B、根据盖斯定律,用题干中热化学方程式②-①得到I2(s) I2(g)-35.96KJ/L,即1mol固态碘与1mol气态碘所含的能量相差35.96kJ,故B错误;C、气态I2比固态I2能量高,反应②中反应物总能量比反应①的反应物总能量低,故C正确;D、两个反应中的产物均为HI,能量相同,稳定性相同,故D错误,答案选C。
I2(g)-35.96KJ/L,即1mol固态碘与1mol气态碘所含的能量相差35.96kJ,故B错误;C、气态I2比固态I2能量高,反应②中反应物总能量比反应①的反应物总能量低,故C正确;D、两个反应中的产物均为HI,能量相同,稳定性相同,故D错误,答案选C。
考点:考查反应热的计算、热化学方程式的应用以及物质稳定性判断等

 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是
| A.Q1< Q2 |
| B.石墨不如金刚石稳定 |
| C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低 |
| D.质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多 |
下列有关化学反应能量变化的叙述一定正确的是
| A.生成物总能量大于反应物总能量,该反应为放热反应 |
| B.一个化学反应需要加热才能进行,该反应为吸热反应 |
| C.应用盖斯定律,可计算某些难以直接测量的化学反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的?H不同 |
已知: (1)NH3(g)+HCl(g)=NH4Cl(s); △H1=-76kJ·mol-1
(2)NH3(g)+H2O(l)=NH3·H2O(aq); △H2=-35.1kJ·mol-1
(3)HCl(g)+HCl (aq); △H3=-72.3kJ·mol-1
(4)HCl (aq) NH3·H2O(aq) =NH4Cl(aq)+H2O(l); △H4=-52.3kJ·mol-1
(5)NH4Cl(s)=NH2Cl(aq); △H5=?
根据盖斯定律,则(5)方程式中的反应热△H5为
| A.-335.7 kJ·mol-1 | B.-16.3 kJ·mol-1 |
| C.+16.3 kJ·mol-1 | D.-83.7 kJ·mol-1 |
臭氧层是地球上生物的保护层,在平流层存在:2O3 3O2 ;O3
3O2 ;O3 O+ O2。某些微粒X(X为Cl、Br等) 能加速O3的分解:X+O3→XO+ O2; XO+O→X + O2。已知: 2O3
O+ O2。某些微粒X(X为Cl、Br等) 能加速O3的分解:X+O3→XO+ O2; XO+O→X + O2。已知: 2O3 3O2 +144.8 kJ ; t ℃时K=3×1076。下列说法错误的是
3O2 +144.8 kJ ; t ℃时K=3×1076。下列说法错误的是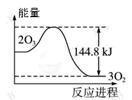
| A.氟利昂释放出的氯原子是臭氧层中促进O3分解的催化剂 |
| B.高压放电条件下O2可以转化成O3 |
| C.O3转变为O2时的能量变化可用右图表示 |
D.t ℃时3O2 2O3 K≈3.33×10-77 2O3 K≈3.33×10-77 |
由金红石(TiO2)制取单质Ti涉及到的步骤为:
TiO2 TiCl4
TiCl4 Ti
Ti
已知:①C(s)+O2(g)=CO2(g) DH=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) DH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) DH=+141kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH是
| A.-80kJ·mol-1 | B.-160kJ·mol-1 | C.160kJ·mol-1 | D.80kJ·mol-1 |
下列说法不正确的是
A.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡正向移动 NH3·H2O+H+达到平衡后,升高温度平衡正向移动 |
| B.在海轮的外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C.明矾水解生成Al(OH)3胶体,可用作净水剂 |
| D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0 |
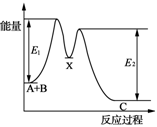
下列反应既是氧化还原反应,又是吸热反应的是( )
| A.铝片与稀H2SO4的反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的炭与CO2的反应 | D.甲烷在O2中的燃烧反应 |