题目内容
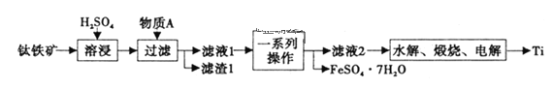
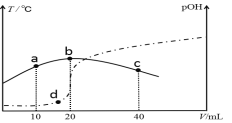
【题目】向VmL0.1mol/L氨水中滴加等物质的量浓度的稀H2SO4,测得混合溶液的温度和pOH[pOH=-lgc(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化),下列说法不正确的是( )
A. a、b、c三点由水电离的c(H+)依次减小
B. V=40
C. b点时溶液的pOH>pH
D. a、b、d三点对应NH3·H2O的电离常数:K(b)>K(d)>K(a)
【答案】A
【解析】
向V mL 0.1mol/L氨水中滴加等物质的量浓度的稀H2SO4,反应放热,溶液的温度升高,当二者恰好完全反应时,放热最多,溶液的温度最高,所以硫酸的体积为20mL时,恰好完全反应。
A、酸碱溶液抑制了水的电离,铵根离子水解促进了水的电离;
B、根据硫酸的物质的量计算氨水的体积;
C、b点时硫酸与氨水恰好反应生成硫酸铵,溶液显酸性;
D、升高温度促进NH3H2O的电离,电离常数增大。
向V mL 0.1mol/L氨水中滴加等物质的量浓度的稀H2SO4,反应放热,溶液的温度升高,当二者恰好完全反应时,放热最多,溶液的温度最高,所以硫酸的体积为20mL时,恰好完全反应。
A、b点硫酸与氨水恰好反应生成硫酸铵,此时铵根离子水解促进了水的电离,则b点水的电离程度最大;a点加入10mL硫酸,氨水过量使溶液呈碱性,c点加入40mL硫酸,硫酸过量使溶液呈酸性,c点氢离子浓度大于a点氢氧根离子浓度,则水的电离程度a>c,所以水的电离程度大小为:b>a>c,故A选;
B、硫酸的体积为20mL时,恰好完全反应,则消耗硫酸的物质的量为0.1mol/L×0.02L=0.0002mol,则氨水的物质的量为0.004mol,所以氨水的体积为:![]() ,即V=40,故B不选;
,即V=40,故B不选;
C、b点时硫酸与氨水恰好反应生成硫酸铵,溶液显酸性,则c(H+)>c(OH),所以pOH>pH,故C不选;
D、升高温度促进NH3H2O的电离,电离常数增大,由图可知,温度:b>d>a,则a、b、d三点NH3H2O的电离常数:K(b)>K(d)>K(a),故D不选;

【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古诗文对应的化学知识正确的是
常见古诗文记载 | 化学知识 | |
A | 《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折” | 铁的合金硬度比纯铁的大,熔点比纯铁的高 |
B | 《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛” | 强水为氢氟酸 |
C | 《天工开物》中记载:凡火药,硫为纯阳,硝为纯阴 | 硫指的是硫黄.硝指的是硝酸钾 |
D | 《泉州府志》中记载:安南人黄姓者为宅煮糖,墙塌压糖,去土而糖白,后人遂效之 | 糖白的过程发生了化学变化 |
A. AB. BC. CD. D