题目内容
18.一定量的稀盐酸跟过量锌粉反应时,为了加快反应速率又不影响生成H2的总量,可采取的措施是( )| A. | 加入少量稀NaOH溶液 | B. | 加入少量CH3COONa固体 | ||
| C. | 加入少量NH4HSO4固体 | D. | 加入少量CuSO4溶液 |
分析 一定量的稀盐酸跟过量锌粉反应时,且不影响生成氢气的总量,可以采用增大稀盐酸浓度、加入铜片、升高温度的方法,据此分析解答.
解答 解:A.加入少量稀NaOH溶液,NaOH和稀盐酸反应生成氯化钠和水,稀盐酸浓度降低、物质的量减小,所以反应速率降低、且生成氢气的总量减少,故A错误;
B.加入少量醋酸钠,醋酸钠和稀盐酸反应生成醋酸,醋酸是弱电解质,部分电离,导致溶液中氢离子浓度减小,反应速率减小,但生成氢气总量不变,故B错误;
C.加入少量硫酸氢铵,硫酸氢铵完全电离生成氢离子,相当于增大氢离子浓度,反应速率加快,且增大生成氢气总量,故C错误;
D.加入少量硫酸铜溶液,锌和铜离子反应生成Cu和锌离子,Zn、Cu和稀盐酸构成原电池加快反应速率,且生成氢气总量不变,故D正确;
故选D.
点评 本题考查化学反应速率影响因素,为高频考点,温度、浓度、催化剂、反应物接触面积等都影响反应速率,易错选项是C,加入硫酸氢铵相当于加入强酸溶液,题目难度不大.

练习册系列答案
相关题目
6.在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g).已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.2mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A. | Z为0.3 mol•L-1 | B. | Y2为0.4 mol•L-1 | C. | X2为0.2 mol•L-1 | D. | Z为0.4 mol•L-1 |
3.下列物质的溶液在蒸发皿加热蒸干、灼烧,可以得到该物质固体的是( )
| A. | AlCl3 | B. | Na2SO3 | C. | KMnO4 | D. | MgSO4 |
10.下列关于有机物类别说法正确的是( )
| A. | 含有碳碳双键的有机物都属于烯烃 | |
| B. | 一氯甲烷、二氯甲烷、三氯甲烷与四氯甲烷互为同系物 | |
| C. | 两种烃的含碳量相同,则一定互为同分异构体 | |
| D. | 苯酚与苯甲醇都属于烃的含氧衍生物 |
7. 如图是元素周期表短周期的一部分,A、B两种元素可以形成B2A2,分子中所有原子的最外层电子都达到8个电子的稳定结构.下列说法不正确的是( )
如图是元素周期表短周期的一部分,A、B两种元素可以形成B2A2,分子中所有原子的最外层电子都达到8个电子的稳定结构.下列说法不正确的是( )
 如图是元素周期表短周期的一部分,A、B两种元素可以形成B2A2,分子中所有原子的最外层电子都达到8个电子的稳定结构.下列说法不正确的是( )
如图是元素周期表短周期的一部分,A、B两种元素可以形成B2A2,分子中所有原子的最外层电子都达到8个电子的稳定结构.下列说法不正确的是( )| A. | B为氧元素A为氟元素 | B. | 该化合物形成的分子式为S2Cl2 | ||
| C. | 该化合物为共价化合物 | D. | B位于元素周期表第15纵行 |
8.1mol/L的CuSO4溶液是( )
| A. | 溶液中含有1mol CuSO4 | |
| B. | 1L水中加入160g CuSO4 | |
| C. | 1mol CuSO4溶于1mol水中 | |
| D. | 将250g CuSO4•5H2O溶于少量水后再稀释成1000mL |

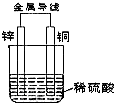 根据如图铜锌原电池示意图,回答下列问题:
根据如图铜锌原电池示意图,回答下列问题: