题目内容
13.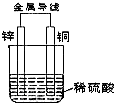 根据如图铜锌原电池示意图,回答下列问题:
根据如图铜锌原电池示意图,回答下列问题:(1)锌片负电子,发生氧化反应,电极反应式为Zn-2e-=Zn2+;
(2)在电池的工作过程中,Zn极质量变化了3.25g,则Cu极不变(填“增加”、“不变”或“减少”),电路中转移电子为0.1mol.
分析 (1)在原电池中较活泼的金属作负极,失电子发生氧化反应,电子经导线传递到正极,溶液中阳离子移向正极,阴离子移向负极.Zn比Cu活泼,Zn做负极电极反应式为:Zn-2e-=Zn2+;
(2)由于正极是氢离子得到电子,所以Cu电极质量不变,根据电极反应式Zn-2e-=Zn2+,分析求解.
解答 解:(1)在原电池中较活泼的金属作负极,失电子发生氧化反应,电子经导线传递到正极,溶液中阳离子移向正极,阴离子移向负极.Zn比Cu活泼,Zn做负极电极反应式为:Zn-2e-=Zn2+,
故答案为:负;氧化;Zn-2e-=Zn2+;
(2)由于正极是氢离子得到电子,所以Cu电极质量不变,根据电极反应式Zn-2e-=Zn2+,Zn极质量变化了3.25g,说明参加反应的锌为$\frac{3.25g}{65g/mol}$=0.05mol,所以转移电子数目为:0.05mol×2=0.1mol,故答案为:不变;0.1.
点评 本题考查了原电池的相关知识,注意原电池的形成条件、电子守恒,题目难度中等.

练习册系列答案
相关题目
8.下列说法中正确的是( )
| A. | 在化学反应中一定有新物质生成,同时也一定有能量的变化 | |
| B. | 在化学反应中一定有新物质生成,但不一定有能量的变化 | |
| C. | 在化学反应中不一定有化学键的变化 | |
| D. | 在化学反应中一定有化学键的变化,但不一定有能量的变化 |
18.一定量的稀盐酸跟过量锌粉反应时,为了加快反应速率又不影响生成H2的总量,可采取的措施是( )
| A. | 加入少量稀NaOH溶液 | B. | 加入少量CH3COONa固体 | ||
| C. | 加入少量NH4HSO4固体 | D. | 加入少量CuSO4溶液 |
5.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,下列关系式中正确的是( )
| A. | c (Na+)=2c(CH3COO-)+2c(CH3COOH) | B. | c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | c (Na+)>c (CH3COO-)>c(OH-)>c(H+) | D. | c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |


 ⑥苯 ⑦甲苯 ⑧乙烯 ⑨乙醇
⑥苯 ⑦甲苯 ⑧乙烯 ⑨乙醇