题目内容
19.下列各对物质中,互为同分异构体的是( )| A. | CH3CH2CH2CH3和CH3CH=CHCH3 | B. | CH3CH=CHCH3和 CH3C≡CCH3 | ||
| C. | CH3CH=CHCH3和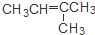 | D. | CH3CH2CH2OH和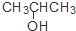 |
分析 具有相同分子式而结构不同的化合物互为同分异构体;据此概念对各个选项进行判断即可.
解答 解:A、CH3CH2CH2CH3和CH3CH=CHCH3两者的分子式分别为C4H10和C4H8,分子式不相同,不是同分异构体,故A错误;
B、CH3CH=CHCH3和 CH3C≡CCH3两者的分子式分别为C4H8和C4H6,分子式不相同,不是同分异构体,故B错误;
C、CH3CH=CHCH3和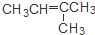 两者的分子式分别为C4H8和C5H10,分子式不相同,不是同分异构体,故C错误;
两者的分子式分别为C4H8和C5H10,分子式不相同,不是同分异构体,故C错误;
D、CH3CH2CH2OH和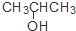 两者的分子式分别为C3H8O和C3H8O,分子式相同,是同分异构体,故D正确,故选D.
两者的分子式分别为C3H8O和C3H8O,分子式相同,是同分异构体,故D正确,故选D.
点评 本题主要考查了有机化合物的同分异构体的判断和理解,掌握概念实质是解题关键,题目较简单.

练习册系列答案
相关题目
9.下列关于能量转换的认识中不正确是( )
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 煤燃烧时化学能主要转化为热能 | |
| C. | 绿色植物进行光合作用时,太阳能转化为化学能 | |
| D. | 白炽灯工作时电能全部转变成光能 |
10. 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )
 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )| A. | 放出1 638 kJ的热量 | B. | 吸收1 638 kJ的热量 | ||
| C. | 放出126 kJ的热量 | D. | 吸收126 kJ的热量 |
7.下列说法不正确的是( )
| A. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2 c (Na+)=c(CH3COO-)+c(CH3COOH) | |
| B. | 将0.4mol/LNH4Cl溶液和0.2mol/LNaOH溶液等体积混合后,溶液中粒子的物质的量浓度大小关系为:c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | 将纯水加热至较高温度,水的离子积变大,pH变大,呈中性 | |
| D. | 将稀氨水加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}.{H}_{2}O)}$ 增大 |
14.已知金刚石在一定条件下转化为石墨是放热的.据此以下说法正确的是( )
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 反应是放热还是吸热,须看反应物和生成物所具有的总能量的相对大小 | |
| D. | 金刚石比石墨稳定 |
4.奥运会开幕式上的焰火“脚印”、“笑脸”、“五环”让奥运会更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关.下列说法中正确的是( )
| A. | 焰色反应均应透过蓝色钴玻璃观察 | |
| B. | NaC1与Na2CO3灼烧时火焰颜色相同 | |
| C. | 焰色反应是化学变化 | |
| D. | 所有金属及其化合物灼烧时火焰均有颜色 |
8.下列说法中正确的是( )
| A. | 两个原子或多个原子之间的相互作用叫化学键 | |
| B. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 | |
| C. | 只有金属元素和非金属元素化合时才能形成离子键 | |
| D. | 离子化合物中一定含有离子键 |
9.醋酸是重要的一元酸,在有机和无机反应中都有应用.
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表:由表中数据推测,数值x的范围是1.57<x<1.76.
(2)现有25℃时,pH=3的醋酸.请回答以下问题:
①若向醋酸中加入少量醋酸钠固体,此时溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$将减小(填“增大”“减小”或“不变”);
②若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH>7(填“>”“<”或“=”),用离子方程式解释其原因CH3COO-+H2O?CH3COOH+OH-.
③若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
④当醋酸的浓度为0.1mol/L时,此时醋酸的电离常数约为1×10-5.
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表:由表中数据推测,数值x的范围是1.57<x<1.76.
| 反应 | 乙醇(mol) | 乙酸(mol) | 乙酸乙酯(mol) |
| 1 | 2 | 2 | 1.33 |
| 2 | 3 | 2 | 1.57 |
| 3 | 4 | 2 | x |
| 4 | 5 | 2 | 1.76 |
①若向醋酸中加入少量醋酸钠固体,此时溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$将减小(填“增大”“减小”或“不变”);
②若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH>7(填“>”“<”或“=”),用离子方程式解释其原因CH3COO-+H2O?CH3COOH+OH-.
③若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
④当醋酸的浓度为0.1mol/L时,此时醋酸的电离常数约为1×10-5.