题目内容
【题目】过氧化碳酰胺[CO(NH2)2H2O2]是一种高效、安全的固体消毒剂,白色晶体,易溶于水,稍高温度时可发生分解。某化学小组欲制备少量过氧化碳酰胺,并测定其活性氧的含量,回答下列问题。
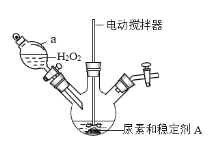
(一)过氧化碳酰胺的制备
(1)制备过氧化碳酰胺的发生装置如图所示(夹持装置略去),在组装仪器前应对a装置进行的操作是________。
(2)该反应的最佳温度为35℃,采用的合适加热方式为________。
(二)过氧化碳酰胺中活性氧含量的测定(以产品中过氧化氢所含氧原子的质量分数为准计算)。称取10.0g产品,配成250mL溶液,取25.00mL溶液于锥形瓶中,加入适量稀硫酸,用0.10molL-1高锰酸钾标准溶液滴定三次,消耗高锰酸钾溶液的体积分别为21.02mL、21.23mL、20.98mL。
(1)写出KMnO4标准溶液与H2O2反应的化学方程式____________。
(2)过氧化碳酰胺中活性氧含量为_____%。若配制过氧化碳酰胺溶液定容时俯视刻度线,则测得过氧化碳酰胺中活性氧含量______(填“偏高”“偏低”或“无影响”)。
(三)稳定剂A对过氧化碳酰胺的制备有一定的影响,小组成员查阅文献资料得到有关稳定剂及数据如表所示。则选择最佳稳定剂A为________,理由是_____________。
稳定剂名称 | 过氧化碳酰胺活性氧的含量/10-2 | ||||
初始数 | 室温储存30天后数 | 减少量 | 热储存保温1天后数 | 减少量 | |
EDTA | 16.96 | 16.87 | 0.09 | 16.92 | 0.04 |
柠檬酸 | 16.94 | 16.90 | 0.04 | 16.91 | 0.03 |
EDTA与柠檬酸混合物 | 16.95 | 16.90 | 0.05 | 16.90 | 0.05 |
柠檬酸与焦磷酸钠混合物 | 16.90 | 16.86 | 0.04 | 16.87 | 0.03 |
【答案】检查是否漏水 水浴加热 2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O 16.8 偏高 柠檬酸 不论室温储存30天后,还是热储存保温1天后,过氧化碳酰胺活性氧含量减少率都最少
【解析】
(二)过氧化碳酰胺中活性氧含量的测定
活性氧的含量以产品中过氧化氢所含氧原子的质量分数为准计算,过氧化氢中的氧原子为-1价,既有氧化性又有还原性,本实验的滴定原理是利用酸性高锰酸钾来氧化双氧水中的氧元素,通过消耗的高锰酸钾的量来确定过氧化氢中氧元素的量。
(一)(1)装置a为分液漏斗,使用之前需要检查该装置是否漏水;
(2)该反应的最佳温度为35℃,所以可以采用水浴加热的方法;
(二)(1)KMnO4标准溶液与H2O2反应时,高锰酸钾作为氧化剂,将双氧水中-1价氧元素氧化为0价,生成氧气,同时自身被还原成Mn2+,根据电子守恒和原子守恒可得化学方程式为2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O;
(2)第二组数据偏差较大,舍去,所以消耗的高锰酸钾溶液的平均体积为![]() =21.00mL,n(KMnO4)=0.02100L×0.10mol/L=0.0021mol,根据反应方程式可知双氧水中n(O)=n(KMnO4)×
=21.00mL,n(KMnO4)=0.02100L×0.10mol/L=0.0021mol,根据反应方程式可知双氧水中n(O)=n(KMnO4)×![]() ×2=0.0105mol,所以样品中n(O)=0.0105mol×
×2=0.0105mol,所以样品中n(O)=0.0105mol×![]() =0.105mol,活性氧的含量为
=0.105mol,活性氧的含量为![]() =16.8%;
=16.8%;
若配制过氧化碳酰胺溶液定容时俯视刻度线,导致配制的过氧化碳酰胺溶液浓度偏大,滴定过程中消耗的高锰酸钾的量偏大,测定结果偏高;
(三)据图可知选用柠檬酸作为稳定剂时,不论室温储存30天后,还是热储存保温1天后,过氧化碳酰胺活性氧含量减少率都最少,所以最佳稳定剂A为柠檬酸。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案