题目内容
【题目】下列化学用语表示正确的是( )
A. 过氧化钠的化学式: Na2O2
B. Mg2+的结构示意图: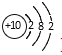
C. 明矾的化学式:Al2(SO4)3
D. 碳酸氢钠的电离方程式:CH3COOH=H+ + CH3COO-
【答案】A
【解析】
A.过氧化钠的化学式为Na2O2,故A正确;
B.镁离子的原子核内有12个质子,核外只有2个电子层,最外层是8个电子,离子结构示意图为:![]() ,故B错误;
,故B错误;
C.明矾化学式中含有结晶水,其正确的化学式为:KAl(SO4)212H2O,故C错误;
D.碳酸氢钠属于强电解质,完全电离,碳酸氢根离子是多元弱酸碳酸的酸式盐的酸根离子,不能完全电离,所以不能拆写,正确电离方程式为:NaHCO3═HCO3-+Na+,故D错误。
故选A。

练习册系列答案
相关题目
【题目】下表中用途与其性质或原理对应关系不正确的是![]()
选项 | 现象或事实 | 解释 |
A |
|
|
B | 常用铝箔做包装材料 | 金属铝有好的延展性 |
C |
|
|
D | 用小苏打治疗胃酸过多 |
|
A. AB. BC. CD. D
【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)
物质 | 除杂试剂 | 操作 | |
A | CO2 (HCl) | 氢氧化钠溶液 | 洗气 |
B | FeCl2 溶液 (FeCl3) | 铜粉 | 充分反应后过滤 |
C | Na2CO3固体(NaHCO3) | 无 | 充分加热 |
D | Fe2O3 (Al2O3) | 稀硫酸 | 充分反应后过滤 |
A. A B. B C. C D. D