题目内容
【题目】下表是元素周期表的一部分,回答下列问题:
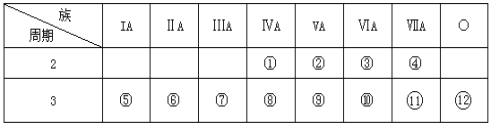
(1)写出①、②两种元素的名称______ ,______。
(2)这些元素的最高价氧化物的对应水化物中________碱性最强;能形成两性氢氧化物的元素是________。
(3)比较⑤与⑥的化学性质,________更活泼,试用实验证明此现象(简述操作、现象和结论) _______。
【答案】碳 氮 NaOH Al 钠 金属钠和金属镁的单质分别与冷水反应,反应剧烈程度大的是钠,反之是镁
【解析】
首先根据元素在周期表中的位置判断出元素,然后结合元素周期律以及相关物质的性质分析解答。
根据元素在周期表中的相对位置可知①~分别是C、N、O、F、Na、Mg、Al、Si、P、S、Cl、Ar。则
(1)①、②两种元素的名称分别是碳、氮。
(2)金属性越强,最高价氧化物的对应水化物的碱性越强,则这些元素的最高价氧化物的对应水化物中NaOH碱性最强;氢氧化铝是两性氢氧化物,因此能形成两性氢氧化物的元素是Al。
(3)同周期自左向右金属性逐渐减弱,则钠比镁更活泼,可依据二者的单质分别与水反应的剧烈程度判断其金属性强弱,金属钠和金属镁的单质分别与冷水反应,反应剧烈程度大的是钠,反之是镁。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】利用右图实验装置,能得出相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa | 酸性:醋酸>碳酸>苯酚 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | H2O | 电石 | KMnO4 | 乙炔具有还原性 | |
D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)表中元素原子半径最大的是(写元素符号)__________,Z原子核外电子能量最高的电子亚层是__________。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式解释产生该现象的原因:_________________;在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因______________________________________________________。
(4)硫酸工业生产中接触室内发生的反应方程式为______________________________________;
在实际生产中,操作温度选定400—500℃、压强通常采用常压的原因分别是__________________________________________________________________________________________________。