题目内容
1.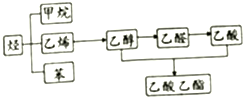 如图是几种重要的有机物及部分转化关系,请回答下列问题:
如图是几种重要的有机物及部分转化关系,请回答下列问题:(1)甲烷是一种重要的清洁能源,写出其燃烧的化学方程式:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;
(2)由乙烯制取乙醇,所发生反应的反应类型为:加成反应;
(3)将适量的苯滴入盛有溴水的试管中,振荡、静置后,观察到的现象为:分层且下层为无色、上层为橙色;
(4)乙醇和乙酸在一定条件下发生反应,可生成带有香味的乙酸乙酯,写出该反应的化学方程式,并注明反应的条件:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
分析 (1)甲烷燃烧生成二氧化碳和水;
(2)乙烯和水在一定条件下发生加成反应生成乙醇;
(3)溴在苯中的溶解度大于在水中的溶解度,且水和苯不互溶;
(4)在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯.
解答 解:(1)甲烷燃烧生成二氧化碳和水,反应方程式为CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,
故答案为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;
(2)乙烯和水在一定条件下发生加成反应生成乙醇,该反应的反应类型是加成反应,故答案为:加成反应;
(3)溴在苯中的溶解度大于在水中的溶解度,且水和苯不互溶,所以苯符合萃取剂条件,则苯能萃取溴水中的溴,苯密度小于水,所以看到的现象是:溶液分层且下层为无色、上层为橙色,故答案为:分层且下层为无色、上层为橙色;
(4)在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
点评 本题考查有机化学反应方程式的书写、萃取、反应类型判断等知识点,明确物质结构及其性质关系是解本题关键,知道萃取剂的选取方法,题目难度不大.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
11.下列变化中属于原电池反应的是( )
| A. | 在空气中金属铝表面迅速氧化形成保护层 | |
| B. | 钢铁在潮湿的空气中生锈 | |
| C. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| D. | 钢管被原油中的含硫化合物腐蚀 |
12.甲烷与氧气的反应式放热反应,下列对应的图象正确的是( )
| A. |  | B. |  | C. |  | D. |  |
16.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z单质在放电条件下发生化合反应 |
6.已知下述三个实验中的物质均能发生化学反应.
下列判断正确的是( )
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
| A. | 实验①和③中的铁钉只作还原剂 | |
| B. | 实验③中反应的离子方程式为Fe+Fe3+═2Fe2+ | |
| C. | 实验②中Fe2+既显氧化性又显还原性 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
10.130mol浓度为3mol•L-1是盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A. | 加入适量的6mol•L-1的盐酸 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入数滴硝酸铜溶液 | D. | 加入适量的氯化钠溶液 |
11.全部由第三周期元素形成的化合物是( )
| A. | HF | B. | NO | C. | Na2S | D. | MgF2 |
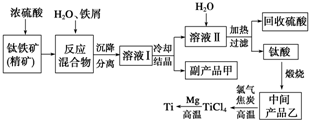 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.