题目内容
16.(1)用“>”“<”或“=”符号填空:能级能量高低:ns< (n+1)s; 在氮气分子中,σ键数<π键数.一般说来,主族序数=价电子数=元素最高正化合价.
(2)某元素+3价离子和氩原子的电子排布相同,离子符号为Sc3+.某元素+3价离子的3d轨道半充满,离子符号为Fe3+.
分析 (1)能层序数相同时,能级越高,能量越高;能级符号相同时,能层序数越大,能量越高;在氮气分子中为氮氮叁键即1个σ键2个π键;一般情况下,主族序数=原子核外电子数(价电子数)=元素的最高化合价,但有例外如F、O,以此规律判断;
(2)某元素+3价离子基态时和氩原子的电子构型相同,该元素质子数=18+3=21;某元素+3价离子基态时的3d轨道半充满,则基态原子外围电子排布为3d64s2.
解答 解:(1)能级符号相同时,能层序数越大,能量越高,故ns<(n+1)s,在氮气分子中为氮氮叁键即1个σ键2个π键,所以σ键数<π键数,一般情况下,主族序数=原子核外电子数(价电子数)=元素的最高化合价,但有例外如F、O,
故答案为:<;<;=;=;
(2)某元素+3价离子基态时和氩原子的电子构型相同,该元素质子数=18+3=21,为Sc元素,离子符号为Sc3+;某元素+3价离子基态时的3d轨道半充满,则基态原子外围电子排布为3d64s2,为Fe元素,离子符号为Fe3+;
故答案为:Sc3+;Fe3+.
点评 本题考查能量变化、核外电子排布以及结构与性质、位置关系,难度不大,注意对核外电子排布规律的理解掌握等规律,熟知这些规律和特例是解题的基础,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.现有下列高分子化合物,请从下列各项中选择出最恰当的选项,将代号填入下表中:
(1)高分子结构形式示意图:
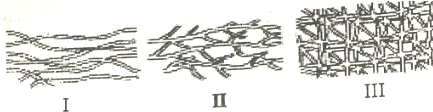
(2)高分子材料的主要性质特点:
A.具有热塑性 B.可溶于有机溶剂 C.不溶于有机溶剂 D.具有确定的熔点
(3)主要应用:(a)用于制备塑料薄膜 (b)用于制备光学仪器 (c) 用于制备车辆轮胎
(1)高分子结构形式示意图:

(2)高分子材料的主要性质特点:
A.具有热塑性 B.可溶于有机溶剂 C.不溶于有机溶剂 D.具有确定的熔点
(3)主要应用:(a)用于制备塑料薄膜 (b)用于制备光学仪器 (c) 用于制备车辆轮胎
硫化橡胶 | 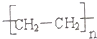 | 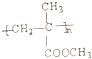 | |
| (1)结构形式示 意图 | |||
| (2)性质特点 | |||
| (3)主要应用 |
4.将同体积同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液中的Cl-恰好完全沉淀,则需同物质的量浓度的AgNO3溶液的体积比为( )
| A. | 6:3:2 | B. | 1:2:3 | C. | 1:1:1 | D. | 3:2:1 |
11.下列离子方程式正确的是( )
| A. | 铁粉加入三氯化铁溶液中:Fe+2Fe3+═3Fe2+ | |
| B. | 钠与水的反应Na+2H2O═Na++2OH -+H2↑ | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 大理石溶于醋酸的反应CaCO3+2H+═Ca2++CO2↑+H2O |
13.下列物质中存在离子键的是( )
| A. | 金刚石 | B. | 干冰 | C. | 氯化钠 | D. | 铁 |