题目内容
3.某元素的原子17X,它的原子核中有20个中子.(1)该元素在周期表中的位置第三周期ⅦA族;
(2)它与原子序数为12的元素形成的化合物化学式是MgCl2;
(3)0.05mol该化合物可以和0.5mol/L的AgNO3溶液200mL完全反应生成白色沉淀14.35g.
分析 (1)元素原子质子数为17,主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)该元素为Cl,原子序数12的元素为Mg,二者反应生成氯化镁;
(3)发生反应:MgCl2+2AgNO3=2AgCl↓+Mg(NO3)2,生成AgCl白色沉淀,根据方程式计算消耗硝酸银物质的量、生成AgCl的物质的量,根据V=$\frac{n}{c}$计算硝酸银溶液体积,根据m=nM计算AgCl的质量.
解答 解:(1)元素原子质子数为17,原子核外有3个电子层,最外层电子数为7,处于周期表中第三周期ⅦA族,
故答案为:第三周期ⅦA族;
(2)该元素为Cl,原子序数12的元素为Mg,二者反应生成MgCl2,故答案为:MgCl2;
(3)设需要硝酸银物质的量为x,生成AgCl的物质的量为y,则:
MgCl2+2AgNO3=2AgCl↓+Mg(NO3)2
1 2 2
0.05mol x y
所以x=y=0.05mol×2=0.1mol
故需要硝酸银溶液体积为$\frac{0.1mol}{0.5mol/L}$=0.2L=200mL,
生成AgCl的质量为0.1mol×143.5g/mol=14.35g,
反应生成AgCl为白色沉淀,
故答案为:200;白;14.35.
点评 本题考查原子结构与元素性质、化学方程式的有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列有关化学用语正确的是( )
| A. | 乙烯的最简式C2H4 | B. | 乙醇的结构简式C2H6O | ||
| C. | 苯的分子式C6H6 | D. | 四氯化碳的电子式 |
14.下列递变规律不正确的是( )
| A. | Na、Mg、Al还原性依次减弱 | |
| B. | F2、Cl2、Br2、I2单质的氧化性依次减弱 | |
| C. | C、N、O原子半径依次增大 | |
| D. | P、S、Cl最高正价依次升高 |
11.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 相同条件下,NA个CO2分子和NA个H2O分子的体积一定相同 | |
| B. | 含NA个Na+的Na2O溶解于1L水中Na+的物质的量浓度为1mol/L | |
| C. | 电解58.5g熔融的NaCl能产生22.4L氯气(标准状况)和23.0g金属钠 | |
| D. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子书为0.1NA |
18.当前,党的群众路线教育实践活动的主要任务是聚焦到作风建设上,集中解决形式主义、官僚主义、享乐主义和奢靡之风这“四风”问题,下列行为与该活动不符合的是( )
| A. | 分类回收、利用垃圾,减少资源浪费 | |
| B. | 推广使用一次性木筷,减少疾病传染 | |
| C. | 减少公车使用,从而减少化石燃料的使用 | |
| D. | 研究煤和石油脱硫技术,减少酸雨发生 |
8.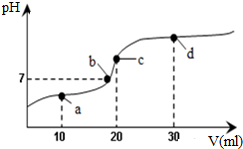 常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )
常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )
 常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )
常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )| A. | a点:c(CH3COO-)>c(Ba2+)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | a至d点过程中:c(Ba2+)一定大于c(OH-) | |
| C. | c点:c(CH3COOH)+c(H+)=c(OH-) | |
| D. | d点:c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+) |
1. 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )
 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )| A. | 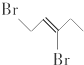 | B. | 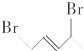 | C. |  | D. | 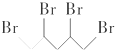 |
2.如图是四位同学学习了元素周期表后,对这节内容的认识,你认为不正确的是( )


| A. | A | B. | B | C. | C | D. | D |
