题目内容
(7分)W、X、Y、Z是短周期主族元素,它们的核电荷数依次增大。下表列出它们的性质和结构:
(1)W和X按1︰1形成的化合物的电子式为 ,晶体Z属于 晶体。
(2)Y元素的单质在W和X按2︰1形成的化合物中反应的离子方程式为。
(3)Z和CO2在一定条件下反应的化学方程式为 。
| 元素编号 | 元素性质或原子结构 |
| W | 原子电子层数与核外电子数相等 |
| X | 原子核外L层上s能级的电子总数为p能级上的电子总数的一半 |
| Y | 元素的原子半径在短周期中最大(除稀有气体外) |
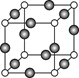
| Z | 原子核外p能级上的电子总数等于s能级上的电子总数 |
(2)Y元素的单质在W和X按2︰1形成的化合物中反应的离子方程式为。
(3)Z和CO2在一定条件下反应的化学方程式为 。
(1)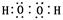 (2分)金属(1分)(2)2Na+2H2O=2Na++2OH-+H2↑(2分)
(2分)金属(1分)(2)2Na+2H2O=2Na++2OH-+H2↑(2分)
(3)2Mg+CO2 2MgO+C(2分)
2MgO+C(2分)
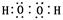 (2分)金属(1分)(2)2Na+2H2O=2Na++2OH-+H2↑(2分)
(2分)金属(1分)(2)2Na+2H2O=2Na++2OH-+H2↑(2分)(3)2Mg+CO2
 2MgO+C(2分)
2MgO+C(2分)试题分析:W原子电子层数与核外电子数相等,则W是氢元素;X原子核外L层上s能级的电子总数为p能级上的电子总数的一半,因此X的原子序数是8,X是氧元素;Y元素的原子半径在短周期中最大(除稀有气体外),则Y是钠元素;Z原子核外p能级上的电子总数等于s能级上的电子总数,则Z是镁元素,则
(1)H和O按1︰1形成的化合物是双氧水,含有极性键和非极性键的共价化合物,其电子式为
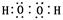 ;金属镁形成的晶体类型是金属晶体。
;金属镁形成的晶体类型是金属晶体。(2)Y元素的单质在W和X按2︰1形成的化合物水中反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑。
(3)Mg和CO2在一定条件下反应的化学方程式为2Mg+CO2
 2MgO+C。
2MgO+C。
练习册系列答案
相关题目
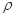 g·cm-3,阿伏加德罗常数为NA,
g·cm-3,阿伏加德罗常数为NA,