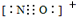题目内容
请回答下列问题:
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
则该元素是 (填写元素符号)。
(2)基态锗(Ge)原子的电子排布式是 ,Ge的最高价氯化物分子式是 ,该元素可能的性质或应用有 ;
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
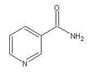
(3)关于化合物 ,下列叙述正确的有
,下列叙述正确的有
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D.该分子在水中的溶解度大于2-丁烯
(4)NaF的熔点 的熔点(填>、=或<),其原因是 。
的熔点(填>、=或<),其原因是 。
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 I1 I2 I3 I4 … |
| In/kJ.mol-1 578 1817 2745 11578 … |
则该元素是 (填写元素符号)。
(2)基态锗(Ge)原子的电子排布式是 ,Ge的最高价氯化物分子式是 ,该元素可能的性质或应用有 ;
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物
 ,下列叙述正确的有
,下列叙述正确的有 A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D.该分子在水中的溶解度大于2-丁烯
(4)NaF的熔点
 的熔点(填>、=或<),其原因是 。
的熔点(填>、=或<),其原因是 。(1)Al
(2)1s22s22p63s23p63d104s24p2;GeCl4 ;CD
(3)BD
(4)>;两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低
(2)1s22s22p63s23p63d104s24p2;GeCl4 ;CD
(3)BD
(4)>;两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低
(1)从表中原子的第一至第四电离能可以看出,元素的第一、第二、第三电离能都较小,可失去3个电子,最高化合价为+3价,即最外层应有3个电子,应为铝元素。
(2)镓是32号元素,核外有32个电子,基态锗(Ge)原子原子的电子排布式为1s22s22p63s23p63d104s24p2,Ge的最高价为+4价,氯化物分子式是GeCl4。
A.Ge是一种金属元素,但最外层电子数为4,金属性不强,故A错误;B.硫的其电负性大于硅,硅的电负性大于锗,所以锗的电负性小于硫,故B错误; C.锗单质是一种半导体材料,故C正确; D.氯化锗和溴化锗都是分子晶体,但氯化锗的相对分子质量小于溴化锗,则氯化锗沸点低于溴化锗的沸点。
(3)A.分子中不存在与电负性强的元素相连的氢原子,所以不存在氢键,故A错误;B.分子中碳碳键是非极性键,碳氢键、碳氧键是极性键,故B正确;C.1个单键是1个σ键,一个双键是1个σ键和1个π键,所以分子中有9个σ键和3个π键,故C错误;D.根据醛基比甲基更溶于水,所以分子红两个甲基被醛基取代,溶解度增大,故D正确。
(4)两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低。
(2)镓是32号元素,核外有32个电子,基态锗(Ge)原子原子的电子排布式为1s22s22p63s23p63d104s24p2,Ge的最高价为+4价,氯化物分子式是GeCl4。
A.Ge是一种金属元素,但最外层电子数为4,金属性不强,故A错误;B.硫的其电负性大于硅,硅的电负性大于锗,所以锗的电负性小于硫,故B错误; C.锗单质是一种半导体材料,故C正确; D.氯化锗和溴化锗都是分子晶体,但氯化锗的相对分子质量小于溴化锗,则氯化锗沸点低于溴化锗的沸点。
(3)A.分子中不存在与电负性强的元素相连的氢原子,所以不存在氢键,故A错误;B.分子中碳碳键是非极性键,碳氢键、碳氧键是极性键,故B正确;C.1个单键是1个σ键,一个双键是1个σ键和1个π键,所以分子中有9个σ键和3个π键,故C错误;D.根据醛基比甲基更溶于水,所以分子红两个甲基被醛基取代,溶解度增大,故D正确。
(4)两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低。

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
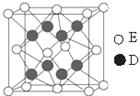
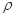 g·cm-3,阿伏加德罗常数为NA,
g·cm-3,阿伏加德罗常数为NA,