题目内容
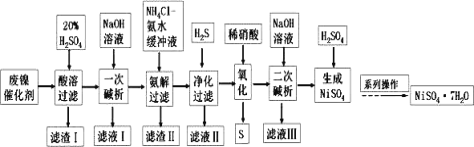
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:
已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
③离子浓度≤10-5mol·L-1时,离子沉淀完全。请回答下列问题:
(1)为提高“酸溶”时镍元素的浸出率,所采取的的措施为____(写1种)。
(2)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为_______。
(3)“氨解”的目的为__ “氨解”时需要控制低温原因是______。
(4)“氧化”时发生反应的化学方程式为_____。
(5)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于_____。(已知:Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(6)若在流程中完成“系列操作”。则下列实验操作中,不需要的是____(填下列各项中序号)。



【答案】废镍催化剂粉碎、增大硫酸浓度、升温一种合理即可 ![]() 实现镍元素和铁元素的分离或除去铁元素 防止氨水分解生成氨气,脱离反应体系,不利于生成[Ni(NH3)6]2+ 3NiS+8HNO3(稀)=3Ni(NO3)2+2NO↑+3S↓+4H2O 1.42×10-5mol·L-1 cd
实现镍元素和铁元素的分离或除去铁元素 防止氨水分解生成氨气,脱离反应体系,不利于生成[Ni(NH3)6]2+ 3NiS+8HNO3(稀)=3Ni(NO3)2+2NO↑+3S↓+4H2O 1.42×10-5mol·L-1 cd
【解析】
废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)经酸溶得到硫酸镍、硫酸铁、硫酸铬溶液,二氧化硅不溶于硫酸为滤渣I的主要成分;向滤液中加入过量氢氧化钠溶液得到氢氧化镍沉淀、氢氧化铁沉淀、偏铬酸钠溶液,偏铬酸钠溶液为滤液I的主要成分;向沉淀中加入NH4Cl-氨水的混合液,氢氧化铁沉淀不溶于此溶液,为滤渣II的主要成分,氢氧化镍沉淀溶于此溶液得到[Ni(NH3)6]2+溶液;向溶液中通入H2S,生成NiS沉淀;向沉淀中滴入稀硝酸得到硝酸镍;向硝酸镍中加入氢氧化钠溶液得到氢氧化镍沉淀;向沉淀中加入硫酸得到硫酸镍;在经过系列操作得到NiSO4·7H2O,据此解答本题。
(1)为提高“酸溶”时镍元素的浸出率,可将废镍催化剂粉碎增加反应接触表面积、增大硫酸浓度、升温等措施,
故答案为:废镍催化剂粉碎、增大硫酸浓度、升温一种合理即可;
(2)根据信息可知,Cr(OH)3是两性氢氧化物,性质类似于氢氧化铝,铬离子与少量氢氧化钠反应生成氢氧化铬,若氢氧化钠过量,则过量的氢氧化钠与氢氧化铬反应生成偏铬酸钠,故“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;
(3)废镍催化剂中的铁元素在“一次碱析”时转化为氢氧化铁,由于Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl-氨水的混合液生成[Ni(NH3)6]2+,则“氨解”的目的是实现镍元素和铁元素的分离或除去铁元素;加热条件下,氨会挥发,因此控制低温的原因是:防止氨水分解生成氨气,脱离反应体系,不利于生成[Ni(NH3)6]2+,
故答案为:实现镍元素和铁元素的分离或除去铁元素;防止氨水分解生成氨气,脱离反应体系,不利于生成[Ni(NH3)6]2+;
(4)“氧化”时发生的反应是稀硝酸和NiS的反应,根据流程图反应生成S,则稀硝酸中氮元素由+5价降低到+2价生成NO,NiS中的硫元素由-2价升高到0价生成S单质,根据得失电子守恒和原子守恒,反应的化学方程式为:3NiS+8HNO3(稀)=3Ni(NO3)2+2NO↑+3S↓+4H2O,
故答案为:3NiS+8HNO3(稀)=3Ni(NO3)2+2NO↑+3S↓+4H2O;
(5)氢氧化镍中存在溶解平衡,Ka=c(Ni2+)×c2(OH-),根据信息,离子浓度≤10-5mol·L-1时,离子沉淀完全,则2×10-15=10-5×c2(OH-),解得c(OH-)=1.4×10-5mol/L,则若使溶液中Ni2+沉淀完全,需维持c(OH-)不低于1.4×10-5mol/L,
故答案为:1.42×10-5mol·L-1;
(6)“系列操作”的目的是从NiSO4溶液中得到NiSO4·7H2O,其操作包括:蒸发浓缩、冷却结晶、过滤,故不需要的操作为cd,
故答案为:cd。