题目内容
【题目】某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-H++A2-(Ka=1.0×10-2),下列说法正确的是
A. 在0.1mol/L的H2A溶液中,c(H+)=0.2mol/L
B. 在0.1mol/L的Na2A溶液中,c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C. 0.1mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
D. 分别将浓度均为0.1mol/L的NaHA和Na 2A溶液等体积混合,其pH一定大于7
【答案】C
【解析】
A.二元酸(H2A)在水中的电离方程式为: H2A=H++HA-,HA-H++A2-(Ka=1.0×10-2),第一步完全电离,第二步部分电离,设电离的HA-为x,则有:[x×(0.1+x)]/(0.1-x)= 1.0×10-2,解之得x=0.0084,所以在0.1mol/L的H2A溶液中,c(H+)=0.1+0.0084=0.1084mol/L,故A错误;
B.二元酸(H2A)在水中的电离方程式为: H2A=H++HA-,HA-H++A2-(Ka=1.0×10-2),可以知道第一步完全电离,第二步部分电离,则在0.1mol/L的Na2A溶液中,存在HA-和A2-离子,且c(A2-)+c(HA-)=0.1mol/L,故B错误;
C. 在0.1mol/L的NaHA溶液中,HA-会发生电离作用,所以c(Na+)>c(HA-);电离 使 溶 液 显 酸 性,c(H+)>c(OH-);但是HA-的电离作用是微弱的,而且在溶液中还存在水的电离作用,因此c(HA-)>c(H+)>c(A2-)。故溶液中的离子浓度的关系是
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故C正确;
D. 由于在NaHA的溶液中存在HA-![]() H++ A2-(Ka=1.0×10-2)将同浓度(0.1 mol·L-1)的NaHA和Na2A溶液等体积混合,由于HA-的电离作用大于水解作用,所以其pH一定小于7,故D错误;
H++ A2-(Ka=1.0×10-2)将同浓度(0.1 mol·L-1)的NaHA和Na2A溶液等体积混合,由于HA-的电离作用大于水解作用,所以其pH一定小于7,故D错误;
故答案选C。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
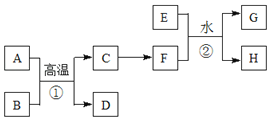
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
I.探究活动一:
备选药品:铁片、锌片、0.5mol/LH2SO4、1.5mol/LH2SO4、18.4mol/LH2SO4
甲同学研究的实验报告
实验步骤 | 现象 | 结论 |
①分别取等体积的1.5mol/L的硫酸于两支试管中; ②_____________________。 | 反应速率: 锌>铁 | 金属的性质越活泼,反应速率越快 |
(1)甲同学实验报告中的实验步骤②为__________________________________。
(2)甲同学的实验目的是_______________________________;要得出正确的实验结论,还需控制的实验条件是__________________。
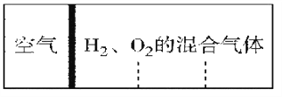
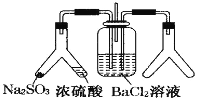
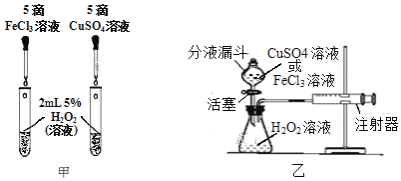
乙同学为了定量研究浓度对化学反应速率的影响,利用如图所示装置进行实验:

(3)乙同学在实验中需要测定的数据是_________________________。
(4)乙同学不会选用___________mol/L硫酸完成该实验,理由是_________________。
II.探究活动二:
备选药品:0.1mol/LNa2S2O3溶液、0.2mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、0.2mol/LH2SO4溶液。
已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
实验 编号 | Na2S2O3用量 | H2SO4用量 | 温度(℃) |
① | 0.1mol/L5mL | 0.1mol/L5mL | 10 |
② | 0.2mol/L5mL | 0.2mol/L5mL | 25 |
③ | 0.1mol/L5mL | 0.1mol/L5mL | 25 |
④ | 0.1mol/L5mL | 0.1mol/L5mL | 40 |
(1)若想探究温度对化学反应速率的影响,可选的实验编号有___________。
(2)若想探究浓度对化学反应速率的影响,可选的实验编号有___________。
(3)在该实验过程中,需要观察和记录________________,来比较化学反应速率的快慢。
(4)Na2S2O3在碱性溶液中可被I2氧化为Na2SO4,写出该反应的离子方程式___________________。