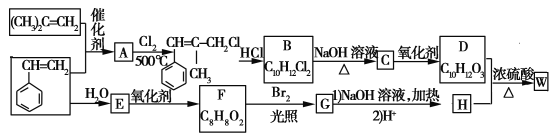
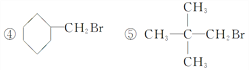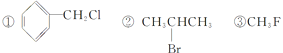题目内容
【题目】下表是元素周期表的一部分,回答下列问题(答题时用具体元素符号表示)。
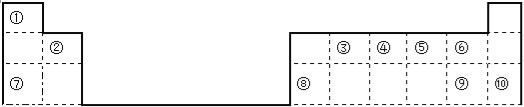
(1)用数字标注的元素中原子半径最小的是 ,半径最大的是 ,化学性质最稳定的是 ,非金属性最强的是 ,最高价氧化物对应的水化物酸性最强的是 。
(2)③最高价氧化物的结构式 ,⑦单质在⑤单质中燃烧产物的电子式
(3)工业制取单质⑦的化学方程式
实验室制取单质⑨的化学方程式
单质⑧与单质⑦的最高价氧化物对应的水化物的离子方程式:
【答案】(1) H、Na、Ar、F、HClO4(2) O=C=O![]() (3)2NaCl(熔融)
(3)2NaCl(熔融)![]() 2Na+ Cl2↑
2Na+ Cl2↑
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 2 Al(OH)3+OH-=AlO2-+2H2O
MnCl2+Cl2↑+2H2O 2 Al(OH)3+OH-=AlO2-+2H2O
【解析】试题分析:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为N,⑤为O,⑥为F,⑦为Na,⑧为Al,⑨为Cl,⑩为Ar,
(1)用数字标注的元素中原子半径最小的是①,半径最大的是⑦,化学性质最稳定的是⑩,非金属性最强的是⑥,最高价氧化物对应的水化物酸性最强的是⑨,故答案为:H、Na、Ar、F、HClO4;
(2)③最高价氧化物为二氧化碳,结构式为O=C=O;钠与氧气燃烧产生过氧化钠,其电子式为;![]() ;
;
(3)利用电解冶炼Na,反应为2NaCl(熔融)![]() 2Na+Cl2↑;利用浓盐酸与二氧化锰制备氯气,反应为MnO2+4HCl(浓)
2Na+Cl2↑;利用浓盐酸与二氧化锰制备氯气,反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;单质⑧与单质⑦的最高价氧化物对应的水化物反应生成偏铝酸钠和氢气,离子反应为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑。
MnCl2+Cl2↑+2H2O;单质⑧与单质⑦的最高价氧化物对应的水化物反应生成偏铝酸钠和氢气,离子反应为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑。

【题目】为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号 | 操作 | 实验现象 |
① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴等浓度 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 | 试管A中不再产生气泡;试管B中产生的气泡量增大 |
② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生 |
(1)过氧化氢分解的化学方程式为 。
(2)实验①的目的是 。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是 (用实验中提供的试剂)。
(4)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

①定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_________________________。