题目内容
【题目】I.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时, 涉及如下反应: 2NO(g) +Cl2(g) ![]() 2ClNO(g) ΔH< 0
2ClNO(g) ΔH< 0
写出该反应的平衡常数表达式 。
为研究不同条件对反应的影响,:在恒温条件下, 向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2, 10 min时反应达到平衡。测得10 min内v(ClNO) =7.5×10-3 mol·L-1·min-1, 则平衡后n(Cl2) = mol, NO的转化率α1= 。其他条件保持不变, 反应在恒压条件下进行, 平衡时NO的转化率α2 α1(填“>” “<” 或“=”), 平衡常数K (填“增大” “减小” 或“不变”) 。若要使K减小, 可采取的措施是 。
II. 实验室可用NaOH溶液吸收NO2, 反应为2NO2+2NaOH![]() NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A, 溶液B为0.1 mol·L-1的CH3COONa溶液, 则两溶液中c(NO3-) 、c(NO2-) 和c(CH3COO-) 由大到小的顺序为 。
NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A, 溶液B为0.1 mol·L-1的CH3COONa溶液, 则两溶液中c(NO3-) 、c(NO2-) 和c(CH3COO-) 由大到小的顺序为 。
(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1, CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是 。
a. 向溶液A中加适量水 b. 向溶液A中加适量NaOH
c. 向溶液B中加适量水 d. 向溶液B中加适量NaOH
III.(1)已知丙醛的燃烧热为![]() ,丙酮的燃烧热为
,丙酮的燃烧热为![]() ,试写出丙醛燃烧热的热化学方程式 。
,试写出丙醛燃烧热的热化学方程式 。
(2)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH) 2,装置如右下图所示,其中P端通入CO2。

①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A. X、Y两端都必须用铁作电极 B. 可以用NaOH溶液作为电解液
C. 阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- D. 白色沉淀只能在阳极上产生
【答案】I.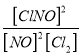 2.5×10-275%> 不变 升高温度
2.5×10-275%> 不变 升高温度
II. c(N![]() ) > c(N
) > c(N![]() ) > c(CH3COO-) b、c
) > c(CH3COO-) b、c
III.(1)![]()
![]() ;
;![]()
(2)①H2-2e-+CO32-=CO2+H2O②BC
【解析】
试题分析:I.该反应的平衡常数表达式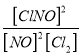 。
。
测得10 min内v(ClNO) =7.5×10-3 mol·L-1·min-1, 则平衡后c(ClNO)= 7.5×10-2 mol·L-1
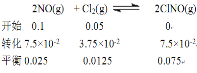
;n(Cl2) =0.025mol; NO的转化率α1=![]() 75%。其他条件保持不变, 反应在恒压条件下进行, 体积减小,和恒容容器比,相当于加压,平衡正向移动,平衡时NO的转化率增大α2>α1, 平衡常数只与温度有关,温度不变K不变。该反应为放热反应,升高温度,平衡逆向移动,K减小。
75%。其他条件保持不变, 反应在恒压条件下进行, 体积减小,和恒容容器比,相当于加压,平衡正向移动,平衡时NO的转化率增大α2>α1, 平衡常数只与温度有关,温度不变K不变。该反应为放热反应,升高温度,平衡逆向移动,K减小。
II.酸性HNO3> HNO2>CH3COOH,溶液A中NaNO3、NaNO2的浓度均为0.1 mol·L-1,溶液B为0.1 mol·L-1的CH3COONa溶液, 则两溶液中c(NO3-) 、c(NO2-) 和c(CH3COO-) 由大到小的顺序为c(N![]() ) > c(N
) > c(N![]() ) > c(CH3COO-)。
) > c(CH3COO-)。
酸性HNO2>CH3COOH,可使溶液A的PH小于和溶液B的pH,要使PH相等,可以的方法是 :向溶液A中加适量NaOH或向溶液B中加适量水;
III.(1)丙醛燃烧热的热化学方程式![]()
![]() ;
;![]() 。
。
(2)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH) 2,装置如右下图所示,其中P端通入CO2。
①石墨I通入氢气,是电源的负极,电极上的电极反应为H2 - 2e-+ CO32- = CO2+H2O。
②电解法制备Fe (OH)2时,采用金属Fe作阳极,阳极方程式为:Fe-2e-=Fe2+;阴极材料可以是铁也可以是其他材料,阴极方程式为: 2H2O+ 2e-= H2↑+ 2OH-,因为氢离子放电破坏水的电离平衡,使氢氧根离子浓度增大,与亚铁离子结合成Fe (OH)2沉淀,所以可以用NaOH溶液作为电解液也可以不用、阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- ;白色沉淀可能在阳极上产生,也可能在两极之间产生。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下面是八种短周期元素的相关信息(已知铍的原子半径为0.089 nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色。
(1)C元素在元素周期表中的位置 。B形成的简单离子的结构示意图 。
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式)。
(3)用电子式表示A、D形成化合物的过程: 。
(4)H、E形成原子个数比为1∶1的化合物中所含化学键类型为 。
(5)GE2的电子式为 ,F与G形成的最简单的化合物的结构式为 。
(6)E的氢化物比C的氢化物的熔沸点高的原因是 。
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示) 。